Лечение нейропатической боли после операции на позвоночнике
Осложнения после операции на позвоночнике могут возникать из-за наличия у пациента тяжелых сопутствующих заболеваний, нарушений свертываемости крови, ошибок медперсонала при подготовке и выполнении хирургических вмешательств. Причиной могут быть выраженные патологические изменения позвоночного столба или индивидуальные особенности его строения, мешающие хирургу качественно выполнить необходимые манипуляции.
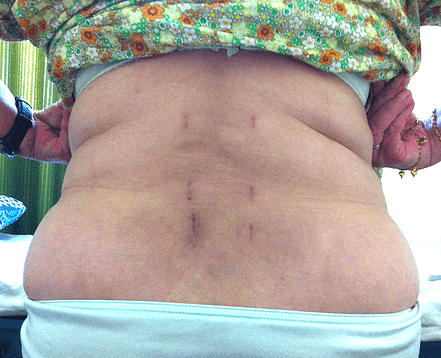
Операционные шрамы через 3 месяца после операции.
Операции чаще всего делают людям с остеохондрозом и его осложнениями (грыжами межпозвонковых дисков, стенозом позвоночного столба, деформацией или нестабильностью отдельных отделов позвоночника). Показаниями также могут быть тяжелые травмы, сколиоз, радикулит, спондилоартроз и т.д.
Общие осложнения
Возникают вне зависимости от вида хирургического вмешательства. Возникают после дискэктомии, ламинэктомии, спондилодеза, протезирования межпозвонковых дисков, хирургического лечения сколиоза и врожденных дефектов строения позвоночного столба. Такие осложнения развиваются после операций на шейном, поясничном, крестцовом отделах позвоночника.
Последствия анестезии(наркоза)
Возникают довольно редко. Могут быть вызваны вредным воздействием средств для наркоза, недостаточным опытом или ошибками анестезиолога, неадекватной оценкой состояния или некачественной предоперационной подготовкой пациента.
Возможные осложнения наркоза:
- механическая асфиксия;
- аспирационный синдром;
- нарушения сердечного ритма;
- острая сердечная недостаточность;
- психозы, бред, галлюцинации;
- рвота или регургитация;
- динамическая кишечная непроходимость.
Чтобы избежать нежелательных последствий анестезии, перед операцией человеку необходимо пройти полноценное обследование. Обо всех выявленных заболеваниях нужно обязательно сообщить анестезиологу. При подготовке к наркозу врач должен учесть возможные риски, выбрать подходящие препараты, адекватно рассчитать их дозировку.
Любопытно! При выходе из наркоза у многих пациентов появляется тошнота и рвота. Они легко купируются 1-2 таблетками или уколом.
После интубации практически всех больных беспокоит першение в горле. Неприятный симптом исчезает спустя несколько дней.
Тромбоэмболические осложнения
Тромбоз глубоких вен нижних конечностей и ТЭЛА могут возникать при многих хирургических вмешательствах. Их появления можно избежать с помощью медикаментозной профилактики и ранней мобилизации пациента. Поэтому всем больным перед операцией обязательно назначают кроворазжижающие средства.
Тромбоз нижних конечностей.
При развитии тромбоэмболических осложнений пациентам надевают компрессионные чулки и повышают дозу антикоагулянтов. Лечение проводят под контролем состояния свертывающей системы крови.
Инфекционные осложнения
Развиваются примерно у 1% больных. Послеоперационные инфекции могут быть поверхностными или глубокими. В первом случае воспаляется только кожа в области разреза, во втором – воспаление распространяется на глубокие ткани, область вокруг спинного мозга, позвонки.
Признаки инфекционных осложнений:
- покраснение и отек в области послеоперационной раны;
- неприятный запах от дренажа;
- гнойные выделения с раны;
- усиливающаяся боль в спине;
- повышение температуры и появление мелкой дрожи.
Гнойное воспаление операционной зоны.
Поверхностные инфекции хорошо поддаются лечению. Обычно врачам достаточно удалить инфицированные швы и назначить антибиотики. При глубоких инфекциях больным требуются повторные операции. Инфекционные осложнения после операции на позвоночнике с применением металлоконструкций могут привести к удалению имплантированных винтов или пластин.
Проблемы с легкими
Нарушение функций дыхательной системы возникает в случае интубации пациента. Причиной может быть воздействие медикаментозных препаратов, механическое повреждение дыхательных путей, аспирация желудочного содержимого или занесение инфекции с интубационной трубкой. Длительный постельный режим нередко приводит к развитию застойной пневмонии.
В послеоперационном периоде медперсонал следит за тем, чтобы пациент глубоко дышал и выполнял кашлевые движения. В профилактических целях больному разрешают как можно раньше садиться и вставать с постели. Если развития пневмонии избежать не удалось – ее лечат с помощью антибиотиков и постурального дренажа.
Кровотечения
Вероятность спонтанного кровотечения особенно высока при операциях с передним или боковым доступом. При их выполнении врачи вынуждены вскрывать брюшную полость или «пробираться» к позвоночнику через клетчаточные пространства шеи. Во время сложных манипуляций даже самый опытный специалист может повредить крупный сосуд или нерв.
Боковой доступ.
Чтобы облегчить доступ к операционному полю, врачи тщательно следят за правильностью укладки пациента. С целью уменьшения кровопотери они используют контролируемую гипотензию. Параллельно с этим медики внимательно следят за тем, чтобы у больного не возникли ишемические повреждения спинного мозга, сетчатки, нервных сплетений, нервов нижней конечности.
Интраоперационные кровотечения менее опасны тех, которые возникают в послеоперационном периоде. Первые останавливают еще в ходе хирургического вмешательства. При вторых пациентам требуется экстренная повторная операция.
Повреждения мозговой оболочки, спинного мозга, нервных корешков
Во время выполнения манипуляций хирург может повредить твердую оболочку, которая окружает спинной мозг. Подобное случается во время 1-3% операций. Если врач сразу же заметил и ликвидировал проблему – человеку можно не беспокоиться. В противном случае у больного могут возникнуть серьезные осложнения.
Последствия утечки спинномозговой жидкости:
- сильные головные боли;
- менингит;
- энцефалит;
- миелит.
Если нарушение целостности мозговой оболочки выявляют в послеоперационном периоде – человека оперируют еще раз.
В редких случаях у пациентов может страдать спинной мозг или выходящие из него нервные корешки. Их повреждение обычно приводит к локальным парезами или параличам. К сожалению, подобные неврологические расстройства плохо поддаются лечению.
Переходный болевой синдром
Характеризуется болью в позвоночно-двигательных сегментах, расположенных рядом с прооперированной частью позвоночника. Неприятные ощущения возникают из-за чрезмерной нагрузки на данный отдел позвоночного столба. Патология чаще встречается среди пациентов, которым делали спондилодез. После операции по удалению грыжи позвоночника данное осложнение развивается крайне редко.
Фиксация поясничного отдела.
Облегчить боли в спине после операции вы можете с помощью лекарственных препаратов, физиопроцедур, специальных упражнений. Обратитесь к лечащему врачу чтобы тот подобрал вам оптимальную схему лечения.
Осложнения в шейном отделе
Операции на шейном отделе позвоночника могут осложняться повреждением нервов, сосудов, мышц или шейных органов. В послеоперационном периоде у некоторых пациентов могут смещаться установленные металлоконструкции.
Таблица 1. Осложнения при разных доступах к позвоночнику.
| Передняя хирургическая экспозиция | |
| Повреждения поворотных гортанных, верхних ларингеальных или гипоглоссальных нервов. | Поворотный гортанный нерв может повреждаться вследствие сдавления эндотрахеальной трубкой или из-за его чрезмерного растяжения во время операции. Патология развивается у 0,07-0,15% больных и приводит к временному или стойкому параличу голосовых связок.Верхний ларингеальный нерв (С3-С4) страдает при переднем доступе к верхней части шейного отдела позвоночника. При его повреждении пациенты жалуются на проблемы со взятием высоких нот при пении.Гипоглоссальный нерв травмируется в 8,6% случаев при доступе к позвоночнику (С2-С4) через передний треугольник шеи. Его повреждение приводит к дисфагии и дизартрии. |
| Повреждение пищевода | У 9,5% пациентов появляется дисфагия. В большинстве случаев она проходящая и вскоре исчезает без каких-либо последствий.Перфорация пищевода возникает всего в 0,2-1,15% случаев. Ее причиной могут быть интраоперационные повреждения, инфекционные осложнения, смещение установленных металлоконструкций и т.д. Перфорацию лечат хирургическим путем. |
| Повреждение трахеи | Может быть вызвано травмой во время интубации или прямой хирургической травмой. Повреждение трахеи очень опасно, поскольку может осложниться пролапсом пищевода, медиастенитом, сепсисом, пневмотораксом, стенозом трахеи или трахео-пищеводной фистулой. Патологию также лечат хирургически. |
| Повреждения сосудов шеи | При выполнении манипуляций на уровне С3-С7 хирург рискует задеть позвоночную артерию. Частота интраоперационных повреждений сосуда составляет 0,3-0,5%. Из-за неправильной хирургической диссекции или чрезмерной тракции у пациента могут пострадать сонные артерии. При повреждении сосудов хирург сразу же восстанавливает их целостность. |
| Задняя хирургическая экспозиция | |
| Дисфункция спинномозгового корешка С5 | Обусловлена его анатомическими особенностями и возникает вследствие чрезмерных тракций в ходе хирургического вмешательства. Обычно проявляется в послеоперационном периоде и исчезает на протяжении 20 дней.В целях профилактики данного осложнения врачи могут выполнять фораминотомию – увеличение размера межпозвонкового отверстия на уровне С5. |
| Постламинэктомический кифоз | Частота кифотических деформаций после многоуровневой ламинэктомии составляет 20%. Примечательно, что послеоперационный кифоз чаще встречается у молодых пациентов. Он развивается постепенно, приводя к мышечному перенапряжению и хронической боли в шее. Специфической профилактики и лечения патологии не существует. |
Осложнения после операций по удалению грыжи поясничного отдела
В 15-20% случаев хирургические вмешательства на пояснице безуспешны и не улучшают самочувствие больного. Основная причина этого – слишком тяжелое состояние пациента. К неудачному исходу лечения приводит поздняя диагностика, низкая квалификация оперирующего хирурга, плохая материально-техническая оснащенность больницы или использование низкокачественных фиксирующих конструкций.
Во время хирургический манипуляций иногда случаются повреждения аорты, идущих к ногам крупных сосудов, спинного мозга, спинномозговых корешков, нервов пояснично-крестцового сплетения. Все это приводит к развитию опасных осложнений (внутреннее кровотечение, дисфункция тазовых органов, нарушение сексуальных функций и т.д.).
Британская ассоциация хирургов-вертебрологов (The British Association of Spine Surgeons, BASS) подсчитала частоту летальных исходов при операциях на поясничном отделе позвоночника. При лечении спинального стеноза смертность составляет 0,003%, спондилолистеза – 0, 0014%.
Замена межпозвонковых дисков и установка фиксирующих приспособлений при спондилодезе может приводить к массе осложнений. Наиболее частые из них – переломы или несращения позвонков, формирование ложных суставов, смещение винтов, пластин или стержней. Во всех этих случаях пациенту требуется повторное хирургическое вмешательство.
Источник
@JesJon,
Представления о механизмах боли при поражении нервного корешка за последние годы значительно изменились. В настоящее время рассматривается несколько гипотез формирования боли при компрессионной радикулопатии [1, 3, 7]. Механическая компрессия корешка приводит к развитию очагов эктопической патологической импульсации, избыточной экспрессии потенциалзависимых натриевых каналов, периферической сенситизации. На этом фоне развивается центральная сенситизация — повышенная чувствительность и избыточная активность сенсорных нейронов заднего рога. Вследствие снижения порога возбуждения этих нейронов любая неболевая периферическая стимуляция может приводить к генерированию болевых импульсов. При длительном персистировании боли снижается активность нисходящих антиноцицептивных влияний, что трактуется как дизингибиция. Указанные механизмы характерны для нейропатической боли и потому боль при радикулопатии стали называть нейропатической [3, 7, 16]. Однако при радикулопатии источником боли могут быть и повреждения ноцицепторов самого межпозвонкового диска. Кроме того, определенную роль играет воспалительный процесс, когда медиаторы воспаления, локально воздействуя на нервные окончания в тканях, также участвуют в генерации болевых ощущений. В таком случае говорят о ноцицептивном компоненте боли.
Таким образом, в формировании боли при радикулопатии принимают участие как нейропатические (эктопическая активность, экспрессия натриевых каналов, центральная сенситизация, дизингибиция), так и ноцицептивные механизмы (активация ноцицепторов, воспаление). Разумеется, нельзя забывать и о существенной роли психогенных и социальных факторов в развитии и хронификации болевого синдрома, что детально обсуждается в специальной литературе [1,12]. Структурные повреждения, вероятно, играют роль тригерра, или запускающего фактора, и в дальнейшем хроническая боль персистирует при доминирующей роли нейропатических механизмов патогенеза (нейропластичности) и психосоциальных факторов, а не морфологических изменений в структурах позвоночника.
С учетом указанных механизмов патогенеза боли при радикулопатии в последние годы все чаще обсуждается целесообразность дифференцированной рациональной фармакотерапии, под которой подразумевают использование препаратов, действующих на нейропатический, ноцицептивный и психогенный компоненты боли [3, 8]. Хорошо известно, что ноцицептивные боли успешно поддаются лечению НПВП, тогда как при нейропатической боли наиболее эффективны антиконвульсанты, антидепрессанты, опиоиды и местные анестетики. При психогенном компоненте целесообразны психотерапия и психотропные средства. Таким образом, уточняя представленность нейропатического, ноцицептивного и психогенного компонентов, можно составить индивидуальную схему лечения, комбинируя препараты с различными механизмами действия.
Клиническая оценка и ее особенности
Клинически бывает достаточно сложно оценить точное соотношение и роль этих компонентов при радикулопатическом болевом синдроме. В наиболее общем виде можно сказать, что нейропатический компонент при болях в нижней части спины характеризуется «прострелами», иррадиацией боли по корешку, жгучими болями в стопе, симптомом Ласега, тогда как ноцицептивный компонент проявляется локальными ноющими, тянущими, пульсирующими болями в пояснично-крестцовой области без иррадиации. К сожалению, существующие дополнительные методы диагностики не всегда позволяют конкретизировать участие и роль того или иного механизма в патогенезе боли. Хорошим подспорьем в дифференцировании клинических компонентов боли могут быть специальные опросники. В России валидизированы скрининговые опросники Pain Detect и DN4 для нейропатической боли [4, 9, 19]. С их помощью можно количественно оценить вероятность присутствия нейропатического компонента при БС.
Проведенные недавно специальные исследования показывают высокую частоту представленности нейропатического компонента при хронических БС [3, 17, 18, 36]. Например, в исследовании, проведенном в США у 213 пациентов с БС, радикулярный болевой синдром встречался в 28% случаев. В популяционном британском исследовании среди всех опрошенных, отмечавших в течение 1 года эпизод БС, 45,6% имели признаки иррадиирующей боли, онемения и покалывания в ногах. В общей популяции эти же признаки были выявлены у 17,8% опрошенных людей. Здесь следует подчеркнуть, что не все случаи иррадиирующей (отраженной) боли можно классифицировать как нейропатические. Согласно определению нейропатическая боль всегда обусловлена органическим поражением (заболеванием) соматосенсорной нервной системы. Соответственно, боль при радикулопатии можно отнести к нейропатической. Однако следует учитывать, что отраженная боль может возникать не только при радикуолопатии, но и вследствие патологии связочного аппарата, перидуральных структур, мышц, фасеточных суставов, дисфункции подвздошно-крестцового сочленения. Например, в исследовании, проведенном в Саудовской Аравии, где с помощью опросника LANSS были протестированы 100 пациентов с БС, было показано, что у 4196 пациентов имеются признаки нейропатической боли [17]. Скорее всего сюда кроме пациентов с истинными радикулярными болями вошли и пациенты с отраженными болями («ненейропатическими»), т.е. не обусловленными поражением нервной системы. Таким образом, данные, полученные в ходе анкетных исследований (с помощью LANSS, DN4, PainDetect), следует трактовать с осторожностью. Нам представляется, что вариабельность распространенности нейропатического компонента при БС связана с применением разных клинических критериев его оценки. Тем не менее, по данным наиболее масштабных исследований с применением стандартной анкеты Pain Detect и клинического анализа, распространенность нейропатического компонента при хронической БС составляет 1,696 в популяции [18].
Лечение
Традиционно терапия БС в большинстве случаев сводится к применению фармакологических средств и методов нелекарственного лечения, таких как массаж, мануальная терапия, чрескожная электронейростимуляция, акупунктура, лазеротерапия и др. Из инвазивных методов широко используются лекарственные блокады с новокаином, кортикостероидами или ботулиническим токсином в различные мышечные точки или суставы. Что касается фармакотерапии, то накоплен большой практический опыт по применению простых анальгетиков, НПВП, мышечных релаксантов, пластин с лидокаином, антидепрессантов, антиконвульсантов, опиоидов. Однако эффективность этих методов в терапии нейропатической БС в большинстве случаев не является очевидной с точки зрения принципов доказательной медицины.
Источник
В статье описаны клинические подходы к диагностике нейропатической боли, приведены Британские рекомендации по лечению нейропатической боли в общесоматической практике и возможности повышения эффективности терапии, в частности рациональное использование комплекса витаминов В в комбинации с габапептиноидами.
Причиной центральной нейропатической боли может являться инсульт, спинальная травма, рассеянный склероз. Нейропатические боли часто ассоциированны с сахарным диабетом, хроническим приемом алкоголя, дефицитом витаминов, хронической болью в спине, радикулярной болью, онкологическими заболеваниями.
Но зачастую конкретная причина нейропатической боли может быть не установлена даже после обследования в специализированном центре.
Поэтому нейропатическая боль может быть разделена на две категории: 1) Хроническое болевое расстройство с нейропатическими характеристиками. 2) Нейропатическая боль, связанная с определенным состоянием.
Нейропатическая боль — это особо тяжёлый вариант хронической боли, проявляющийся интенсивными жгучими или простреливающими болями, продолжающимися в течение длительного времени, до нескольких месяцев. Боль может усиливаться ночью в покое. Пациенты описывают боль как, как жжет, горит, ноет, скребет, дергает, бьет током.
Эти боли возникать спонтанно, т. е. не связанно с обычными провоцирующими факторами (движение, прикосновение к болевой зоне), болевых или других неприятных ощущений (дизестезия). Боль может сопровождается набором чувствительных расстройств, таких как парестезии (покалывание, ползание мурашек), гипералгезия (избыточный ответ на обычный болевой стимул) и аллодиния. Аллодиния – это когда пациент испытывает болевые ощущения в ответ на неболевые раздражения, когда простое легкое прикосновение, холод или тепло приводят к появлению или усилению боли. Аллодиния может быть настолько выражена, что даже прикосновение одежды является очень мучительным для пациента. Даже малейшего ветерка достаточно, чтобы вызвать боль.
У пациентов в зоне болевых ощущений или рядом могут располагаться участки пониженной чувствительности (гипостезия). Эти симптомы свидетельствуют о повреждении и/или гибели отдельных нервных волокон. Гипостезия является частым, но не обязательным симптомом нейропатической боли. При осмотре в зоне болевых ощущений можно выявить трофические изменения: истончение кожи, подкожной клетчатки, нарушение роста волос, ногтей, сухость кожных покровов, изменения дермографизма, цвета и температуры кожи, что свидетельствует о вовлечении в процесс вегетативных волокон.
Боль всегда сопровождается негативными эмоциями. Психопатологические последствия нейропатической боли включают симптомы нарушения настроения, тревоги [2]. Распространенность депрессивных и тревожных расстройств у пациентов с нейропатической болью как минимум в два раза превосходит этот показатель в общей популяции.
Боль вызывает негативные эмоции, которые приводят к изменению порога болевой чувствительности. Это в свою очередь ведет к персистированию болевых симптомов. Депрессия и тревога воздействуют на механизмы формирования и поддержания боли, являются важными модуляторами боли, усиливают интенсивность боли, увеличивают поверхность распространения болевых ощущений. И, наконец, депрессия является независимым фактором нарушения трудоспособности и социальной адаптации у лиц, страдающих хроническим болевым расстройством. У пациентов с нейропатической болью и депрессией качество жизни ниже, а интенсивность боли выше. Около 50%–80% пациентов, страдающих нейропатической болью, имеют нарушения сна с дневными последствиями: усталость, сонливость, нарушение концентрации внимания. Снижается общая эффективность сна. Бессонница также может быть дополнительным фактором риска для развития депрессии и других психопатологических состояний. Таким образом, нейропатическая боль сопряжена с инсомнией и тревожно-депрессивными расстройствами, которые утяжеляют картину боли.
Ученые признают базисные универсальные механизмы, лежащие в основе нейропатической боли, независимо от природы повреждения. Поврежденные нервные волокна претерпевают функциональные изменения, вследствие чего непрерывно посылают неправильные сигналы в другие болевые центры. Изменения, обусловливающие развитие нейрогенного болевого синдрома, происходят как на периферическом уровне, так и в ЦНС.
Лечение нейропатической боли
В начале терапии болевого синдрома, сначала по возможности возможности следует устраненить этиологический фактор. Однако лечение основного заболевания и даже его полное купирование не всегда приводят к исчезновению болевого синдрома. Поэтому собственно боль рассматривается врачом как целевая мишень для терапии, не зависящая от природы повреждения. Перед началом терапии проводится разъяснительная беседа с больным и его родственниками суть которой заключается в том, что лечение может быть длительным, и уменьшение боли будет происходить постепенно. Даже при правильной программе лечения редко удается достичь полного обезболивания. Хорошим результатом считается снижение интенсивности боли на 30%–50% от исходного уровня. Этот параметр следует иметь в виду при оценке эффективности проводимого лечения и решении вопросов о переходе на другой препарат или присоединении нового лекарства к уже принимаемому препарату.
Британские рекомендации по лечению нейропатической боли в общеврачебной практике 2013 г, модернизированные в 2017 г., предлагают в качестве начальной терапии для нейропатической боли любого происхождения, за исключением тригеминальной невралгии, выбор из следующих препаратов: амитриптилин, дулоксетин, габапентин или прегабалин [9]. Из перечисленных препаратов наилучшей переносимостью обладают габапептиноиды (прегабалин, габапентин). Эти препараты характеризуются практически полным отсутствием лекарственных взаимодействий и сравнительно невысокой частотой развития нежелательных явлений. Пациентом с локализованной нейропатической болью на начальном этапе лечения альтернативно можно рекомендовать средства для наружного применения, содержащие капсаицин. Если первоначальное лечение не является эффективным или плохо переносится пациентом, нужно перевести пациента на альтернативную монотерапию препаратом первого ряда или предложить пациенту комбинацию из двух препаратов разных классов. Неэффективное первоначальное лечение требует консультации со специалистом (невролог, альголог) для обсуждения вопроса о назначении препаратов второй линии (лакосамид, ламотриджин, леветирацетам, окскарбазепин, топирамат, венлафаксин, трамадол).
Комбинированная терапия обычно считаются более эффективной, чем монотерапия, но неясно, какие комбинации лучше. Очень мало рандомизированных исследований, посвященных комбинированной терапии нейропатической боли. Но по факту комбинированная терапия используется чрезвычайно широко. К самым часто используемым дополнительным средствам относят Acetyl-L-carnitine, витамины группы В, альфа-липоевая кислота, магнезия [10]. Витамины B1, B6 и B12 действуют в основном как коферменты различных реакций, участвуя в метаболизме углеводов, белков и липидов. Они также играют важную роль в формировании новых клеток, ДНК, РНК и миелина. Абсолютным показанием для их назначения являются состояния, вызванные дефицитом этих витаминов. Дефицит витамина B12 часто наблюдается у пациентов, принимающих метформин, что требует назначения витамина B12 в ежедневной дозе 1000 мкг. Бенфотиамин (жирорастворимая форма тиамина- вит. В1) считается наилучшим вариантом, потому что он лучше проникает через мембраны клетки.
Учет международного и Российского опыта позволяет рекомендовать в качестве инициальной терапии нейропатической боли габапентин (Габагамма) в комбинации с нейротропной терапией Мильгамма в/м №10, с последующим переходом на Мильгамму композитум по 1 драже 3 раза в день шесть недель. Целевая доза габапентина составляет 900 мг/сут., разделенная на 3 приема. При необходимости через 2–4 недели дозу увеличивают.
Лечение нейропатической боли на сегодняшний день продолжает оставаться сложной задачей. Представленные выше принципы и схемы лечения помогают врачу проводить наиболее эффективное и безопасное лечение пациентов с нейропатическим болевым синдромом. Однако, при недостаточной эффективности первоначальной терапии, они не могут заменить индивидуальные консультации со специалистами в конкретных случаях.
Причиной центральной нейропатической боли может являться инсульт, спинальная травма, рассеянный склероз. Нейропатические боли часто ассоциированны с сахарным диабетом, хроническим приемом алкоголя, дефицитом витаминов, хронической болью в спине, радикулярной болью, онкологическими заболеваниями.
Но зачастую конкретная причина нейропатической боли может быть не установлена даже после обследования в специализированном центре.
Поэтому нейропатическая боль может быть разделена на две категории: 1) Хроническое болевое расстройство с нейропатическими характеристиками. 2) Нейропатическая боль, связанная с определенным состоянием.
Нейропатическая боль — это особо тяжёлый вариант хронической боли, проявляющийся интенсивными жгучими или простреливающими болями, продолжающимися в течение длительного времени, до нескольких месяцев. Боль может усиливаться ночью в покое. Пациенты описывают боль как, как жжет, горит, ноет, скребет, дергает, бьет током.
Эти боли возникать спонтанно, т. е. не связанно с обычными провоцирующими факторами (движение, прикосновение к болевой зоне), болевых или других неприятных ощущений (дизестезия). Боль может сопровождается набором чувствительных расстройств, таких как парестезии (покалывание, ползание мурашек), гипералгезия (избыточный ответ на обычный болевой стимул) и аллодиния. Аллодиния – это когда пациент испытывает болевые ощущения в ответ на неболевые раздражения, когда простое легкое прикосновение, холод или тепло приводят к появлению или усилению боли. Аллодиния может быть настолько выражена, что даже прикосновение одежды является очень мучительным для пациента. Даже малейшего ветерка достаточно, чтобы вызвать боль.
У пациентов в зоне болевых ощущений или рядом могут располагаться участки пониженной чувствительности (гипостезия). Эти симптомы свидетельствуют о повреждении и/или гибели отдельных нервных волокон. Гипостезия является частым, но не обязательным симптомом нейропатической боли. При осмотре в зоне болевых ощущений можно выявить трофические изменения: истончение кожи, подкожной клетчатки, нарушение роста волос, ногтей, сухость кожных покровов, изменения дермографизма, цвета и температуры кожи, что свидетельствует о вовлечении в процесс вегетативных волокон.
Боль всегда сопровождается негативными эмоциями. Психопатологические последствия нейропатической боли включают симптомы нарушения настроения, тревоги [2]. Распространенность депрессивных и тревожных расстройств у пациентов с нейропатической болью как минимум в два раза превосходит этот показатель в общей популяции.
Боль вызывает негативные эмоции, которые приводят к изменению порога болевой чувствительности. Это в свою очередь ведет к персистированию болевых симптомов. Депрессия и тревога воздействуют на механизмы формирования и поддержания боли, являются важными модуляторами боли, усиливают интенсивность боли, увеличивают поверхность распространения болевых ощущений. И, наконец, депрессия является независимым фактором нарушения трудоспособности и социальной адаптации у лиц, страдающих хроническим болевым расстройством. У пациентов с нейропатической болью и депрессией качество жизни ниже, а интенсивность боли выше. Около 50%–80% пациентов, страдающих нейропатической болью, имеют нарушения сна с дневными последствиями: усталость, сонливость, нарушение концентрации внимания. Снижается общая эффективность сна. Бессонница также может быть дополнительным фактором риска для развития депрессии и других психопатологических состояний. Таким образом, нейропатическая боль сопряжена с инсомнией и тревожно-депрессивными расстройствами, которые утяжеляют картину боли.
Ученые признают базисные универсальные механизмы, лежащие в основе нейропатической боли, независимо от природы повреждения. Поврежденные нервные волокна претерпевают функциональные изменения, вследствие чего непрерывно посылают неправильные сигналы в другие болевые центры. Изменения, обусловливающие развитие нейрогенного болевого синдрома, происходят как на периферическом уровне, так и в ЦНС.
Лечение нейропатической боли
В начале терапии болевого синдрома, сначала по возможности возможности следует устраненить этиологический фактор. Однако лечение основного заболевания и даже его полное купирование не всегда приводят к исчезновению болевого синдрома. Поэтому собственно боль рассматривается врачом как целевая мишень для терапии, не зависящая от природы повреждения. Перед началом терапии проводится разъяснительная беседа с больным и его родственниками суть которой заключается в том, что лечение может быть длительным, и уменьшение боли будет происходить постепенно. Даже при правильной программе лечения редко удается достичь полного обезболивания. Хорошим результатом считается снижение интенсивности боли на 30%–50% от исходного уровня. Этот параметр следует иметь в виду при оценке эффективности проводимого лечения и решении вопросов о переходе на другой препарат или присоединении нового лекарства к уже принимаемому препарату.
Британские рекомендации по лечению нейропатической боли в общеврачебной практике 2013 г, модернизированные в 2017 г., предлагают в качестве начальной терапии для нейропатической боли любого происхождения, за исключением тригеминальной невралгии, выбор из следующих препаратов: амитриптилин, дулоксетин, габапентин или прегабалин [9]. Из перечисленных препаратов наилучшей переносимостью обладают габапептиноиды (прегабалин, габапентин). Эти препараты характеризуются практически полным отсутствием лекарственных взаимодействий и сравнительно невысокой частотой развития нежелательных явлений. Пациентом с локализованной нейропатической болью на начальном этапе лечения альтернативно можно рекомендовать средства для наружного применения, содержащие капсаицин. Если первоначальное лечение не является эффективным или плохо переносится пациентом, нужно перевести пациента на альтернативную монотерапию препаратом первого ряда или предложить пациенту комбинацию из двух препаратов разных классов. Неэффективное первоначальное лечение требует консультации со специалистом (невролог, альголог) для обсуждения вопроса о назначении препаратов второй линии (лакосамид, ламотриджин, леветирацетам, окскарбазепин, топирамат, венлафаксин, трамадол).
Комбинированная терапия обычно считаются более эффективной, чем монотерапия, но неясно, какие комбинации лучше. Очень мало рандомизированных исследований, посвященных комбинированной терапии нейропатической боли. Но по факту комбинированная терапия используется чрезвычайно широко. К самым часто используемым дополнительным средствам относят Acetyl-L-carnitine, витамины группы В, альфа-липоевая кислота, магнезия [10]. Витамины B1, B6 и B12 действуют в основном как коферменты различных реакций, участвуя в метаболизме углеводов, белков и липидов. Они также играют важную роль в формировании новых клеток, ДНК, РНК и миелина. Абсолютным показанием для их назначения являются состояния, вызванные дефицитом этих витаминов. Дефицит витамина B12 часто наблюдается у пациентов, принимающих метформин, что требует назначения витамина B12 в ежедневной дозе 1000 мкг. Бенфотиамин (жирорастворимая форма тиамина- вит. В1) считается наилучшим вариантом, потому что он лучше проникает через мембраны клетки.
Учет международного и Российского опыта позволяет рекомендовать в качестве инициальной терапии нейропатической боли габапентин (Габагамма) в комбинации с нейротропной терапией Мильгамма в/м
