Недержание мочи после операции на позвоночнике как лечить

Статья посвящена проблеме нейрогенных расстройств мочеиспускания при травме позвоночника и спинного мозга
Путь пациента с осложненной травмой позвоночника, т. е. сопровождающейся повреждением спинного мозга, начинается с нейрохирургического оперативного вмешательства и продолжается многоэтапной реабилитацией, направленной на коррекцию сопутствующих осложнений и восстановление утраченных функций организма [1]. Для таких больных есть специфический термин – «спинальные».
Одним из тяжелейших последствий травмы спинного мозга является расстройство произвольного мочеиспускания, обусловленное нарушением проводимости спинномозговых путей. По данным М.Р. Касаткина, подобное осложнение встречается в 92,1% случаев закрытых повреждений спинного мозга [2]. Патогенез изменений функции нижних мочевых путей при травме спинного мозга, проявляющийся в утрате рефлекторной деятельности, сложен и многообразен [3].
Механизм нормального мочеиспускания и характер его расстройства у спинальных пациентов напрямую связаны с особенностями физиологии этой области. Периферическую иннервацию нижних мочевых путей осуществляют тазовый нерв, представляющий парасимпатическую нервную систему, гипогастральный нерв, реализующий симпатическую регуляцию, и пудендальный соматический нерв. Афферентную информацию несут волокна всех трех нервов – вегетативных от детрузора (гладкой мышцы мочевого пузыря) и уретры и полового нерва от тканей промежности. Первичным анализатором для парасимпатического тазового нерва являются нейроны сакрального центра мочеиспускания, расположенного на уровне S2‒S4 сегментов спинного мозга. Здесь же, в анатомическом соседстве, находится ядро Онуфа, представляющее собой скопление нервных клеток, аксоны которых образуют пудендальный нерв [4]. Симпатическая афферентная иннервация, опосредованная гипогастральным нервом, являющимся частью подчревного и поясничного сплетения, осуществляется через пограничный симпатический ствол и вставочные интернейроны боковых рогов спинного мозга на уровне его Th10‒L2 сегментов. Эти же нервы несут и эфферентные сигналы к иннервируемым органам. Регулирующие структуры спинного мозга связаны с вышерасположенными центрами иннервации проекционно, а также с помощью нейрогуморальных и рефлекторных механизмов [5]. Однако следует отметить, что концепции регуляции функции нижних мочевых путей в норме и патологии являются в большей степени эмпирическими, и единого понимания этого вопроса на сегодняшний день нет.
Клиническая картина
Врачу-неврологу, курирующему пациента с осложненной травмой позвоночника, необходимо оценить уровень и степень повреждения спинного мозга и учесть посттравматические сроки. Клиническая картина в острый и ранний периоды после получения травмы обусловлена спинальным шоком, что проявляется арефлексией и задержкой мочи. По мере восстановления можно наблюдать активизацию рефлекторной деятельности и формирование «в сухом остатке» нейрогенного расстройства мочеиспускания. При повреждении спинного мозга на уровне сакрального центра мочеиспускания и периферических нервных волокон развивается атония или гипотония детрузора, при этом за счет интактности симпатических структур иннервации внутренний уретральный сфинктер сохраняет сократительную способность. Таким образом, нарушается взаимосвязь симпатических и парасимпатических влияний [6]. Клинически наблюдается нейрогенная задержка мочеиспускания с элементами парадоксальной ишурии (выделения мочи по каплям на фоне переполненного мочевого пузыря). При локализации травмы выше сакрального центра и ядра Онуфа повреждаются проводниковые нервные волокна, осуществляющие взаимосвязь регулирующих структур, однако сами центры иннервации могут быть интактны. В этом случае и детрузор, и внутренний сфинктер уретры способны к циклическому сокращению и расслаблению, но рассогласованность в работе приводит не к нормальному акту мочеиспускания, а к детрузорно-сфинктерной диссинергии. Поражение на уровне нижнегрудного и верхнепоясничного отделов позвоночника, вовлекающее симпатические регулирующие структуры, вызывает нарушение сократительной способности внутреннего сфинктера уретры и недержание мочи. Травма спинного мозга на уровне шейного и верхнегрудного отделов позвоночника ведет к прерыванию взаимосвязи спинальных и стволовых, а также кортикальных структур регуляции. В ситуации, когда центры иннервации спинного мозга и нервные проводники между ними сохраняют свою анатомическую целостность, клинически может сформироваться автономный процесс мочеиспускания, а также гиперактивность мочевого пузыря. В этом случае накопление и выделение мочи происходят рефлекторно, в т. ч. с участием аксон-рефлексов, без контроля центров, отвечающих за произвольную составляющую физиологического процесса [7].
Описанные клинические нарушения достаточно вариабельны и зависят от характера и тяжести повреждения, а также сроков, прошедших с момента травмы, поэтому можно наблюдать переход одной формы нейрогенного расстройства мочеиспускания в другую.
Невролог, понимая обусловленность клинической картины уровнем поражения спинного мозга, определяет тактику ведения спинального пациента и дальнейший прогноз. Осуществление адекватной коррекции урологических осложнений лежит, несомненно, в междисциплинарной плоскости. В связи с этим нейроурологическая практика, а вернее, четкое и скоординированное взаимодействие невролога и уролога способно обеспечить квалифицированную и своевременную помощь. И если врач-невролог сосредоточен на повреждении спинного мозга и нарушении иннервации, то уролог контролирует непосредственное функциональное состояние нижних мочевых путей и коррекцию сопутствующих воспалительных и нефротических осложнений. Отсюда вытекает необходимость тесной взаимосвязи специалистов для полноценной коррекции нейрогенных расстройств мочеиспускания.
В представлении уролога, оказывающего специализированную помощь пациентам с неврологическими расстройствами, процесс мочеиспускания выглядит несколько сложнее, чем простой циклический акт, состоящий из чередования фаз накопления и выведения мочи, обеспеченный двумя основными функциями мочевого пузыря: резервуарной и эвакуаторной. Функционально этот процесс определяется синергией детрузора с гладкомышечным сфинктером уретры и мышцами тазового дна, включающими наружный уретральный сфинктер.
Физиологически мочевой пузырь, природой созданный резервуар для сбора мочи, обладает способностью к полному опорожнению в подходящее время и в удобном для совершения акта мочеиспускания месте согласно социально-поведенческим нормам. Эта крайне важная способность реализуется в результате сложной регуляции с участием центральной и периферической нервных систем. Фундаментально акт мочеиспускания – это спинальный рефлекс, обеспечиваемый работой центров головного мозга, реализация и подавление этого рефлекса находятся под волевым контролем. Возможность произвольного управления делает функцию нижних мочевых путей уникальной по сравнению, например, с сердечно-сосудистой системой, и в то же время более уязвимой при неврологических заболеваниях [8]. Таким образом, основными функциями нижних мочевых путей являются накопление мочи в мочевом пузыре, длящееся относительно продолжительное время, и мочеиспускание, занимающее в норме несколько секунд. Реципрокные отношения – расслабление/напряжение детрузора, закрытие уретрального сфинктера и сокращение/расслабление детрузора, открытие уретрального сфинктера – обеспечивают скоординированность процессов накопления и удаления мочи и находятся под нейромедиаторным контролем [9].
Нейрогенная дисфункция нижних мочевых путей является следствием патологии центральной нервной системы или периферических нервных окончаний ‒ отделов нервной системы, выполняющих контроль над актом мочеиспускания. В этом состоит главное отличие рассматриваемого нарушения от нарушений нижних мочевых путей ненейрогенной этиологии, развивающихся вследствие поражения непосредственно мочеполовой системы.
В урологическом сообществе длительное время основной опорой для определения формы нейрогенного расстройства мочеиспускания являлась классификация, предложенная профессором Г. Мадерсбахером в 1980 г. и рекомендуемая Европейской ассоциацией урологов (рис. 1) [10]. В ней автор выделяет 8 основных форм нейрогенных расстройств мочеиспускания в зависимости от состояния детрузора и внутреннего сфинктера уретры. Подразумевается, что указанные структуры могут быть в гипертонусе, гипотонусе и в нормальном состоянии. Однако сложность в постановке диагноза и категоричность в выборе одной из 8 форм нарушений мочеиспускания сегодня заставляют говорить о пересмотре форм расстройств мочеиспускания. С клинической точки зрения все возможные виды нарушений мочеиспускания рассмотреть в рамках одной из существующих классификаций невозможно. В определении поражения у пациента наиболее часто специалисты основываются на преобладающем нарушении эвакуаторной или резервуарной функции мочевого пузыря, различных видах детрузорно-сфинктерной диссинергии и уродинамических показателях максимального детрузорного давления в точке утечки. При этом важность знания о максимальном детрузорном давлении и максимальном давлении в точке утечки делает необходимым проведение специализированного уродинамического исследования практически каждому пациенту с нарушениями мочеиспускания на фоне неврологического заболевания.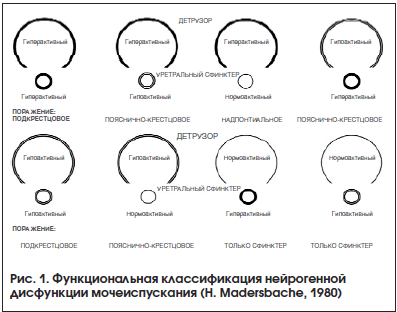
Лечение
Основными задачами урологической помощи на всех этапах нейрореабилитации являются:
1) сохранение и обеспечение функции верхних мочевыводящих путей;
2) независимость регуляции функции нижних мочевыводящих путей;
3) улучшение качества жизни.
С практической точки зрения важны борьба с вторичными осложнениями нейрогенной дисфункции мочеиспускания, а также их профилактика. К таким осложнениям относятся манифестация инфекции мочевыводящих путей (исключая бессимптомную бактериурию), уролитиаз, микроцистис, гидронефротическая трансформация и почечная недостаточность, стриктура уретры и т. д. [11].
Наименьшего риска осложнений со стороны верхних мочевыводящих путей следует ожидать при сохранении резервуарной функции мочевого пузыря с низким внутрипузырным давлением, например при гипотонии детрузора, его достаточной функциональной емкости и нормальном состоянии поперечно-полосатого сфинктера уретры или его гипотонии. В этом случае к хорошим результатам коррекции, в т. ч. улучшению качества жизни спинального пациента, приводит адекватное дренирование нижних мочевых путей, при этом следует руководствоваться международными стандартами и отечественными клиническими рекомендациями. При нарушении функции опорожнения мочевого пузыря вследствие повреждения позвоночника и спинного мозга методом выбора является асептическая периодическая катетеризация. Она подразумевает использование одноразового стерильного лубрицированного катетера. Процедура выполняется самостоятельно или с посторонней помощью каждые 4‒6 ч [12].
Иные методы дренирования мочевого пузыря, такие как приемы Креде или Вальсальвы, длительное использование постоянного мочевого катетера, должны быть строго обоснованы, т. к. несут значительные риски развития вторичных нейрогенных осложнений работы мочевого пузыря, достигающих 34% [13].
Периодическая катетеризация 4‒6 раз в сутки при условии отсутствия выраженных нарушений со стороны верхних мочевыводящих путей, шокового состояния, гнойно-инфекционных процессов в уретре и мочевом пузыре может быть назначена любым специалистом, курирующим пациента. Вопрос о том, когда переводить пациента на периодическую катетеризацию для постоянного уретрального дренажа, находится в стадии обсуждения сообщества специалистов по нейроурологии [14]. Формальных ограничений и четких рекомендаций по срокам нет, однако считается, что при отсутствии противопоказаний и достаточной укомплектованности отделения средним и младшим медицинским персоналом следует избавлять пациента от постоянных дренажей как можно раньше.
Гиперактивный мочевой пузырь, встречающийся на фоне детрузорно-сфинктерной диссинергии и без нее, является другой формой нейрогенного расстройства мочеиспускания вследствие травмы позвоночника и спинного мозга. Если такой тип нарушения клинически проявляется недержанием мочи, то он не несет значительного риска осложнений со стороны верхних мочевыводящих путей. К проблемам нейрогенного гиперактивного мочевого пузыря следует отнести снижение качества жизни.
Детрузорно-сфинктерная диссинергия характеризуется тем, что в момент напряжения мочевого пузыря для его опорожнения происходят различные по силе и продолжительности сокращения внутреннего и наружного сфинктеров уретры, обеспечивающих функцию удержания. В норме сокращения детрузора синхронны с расслаблением этих сфинктеров, что способствует свободному выведению мочи по уретре. Нарушение функции опорожнения в сочетании с высоким внутрипузырным давлением ‒ наиболее опасная форма нейрогенной дисфункции мочеиспускания из-за развития пузырно-мочеточникового рефлюкса, а также возможности структурных повреждений самого мочевого пузыря. В этом случае перед урологом стоят две основные задачи: 1) подавление высокого внутрипузырного давления, 2) обеспечение оттока мочи по уретре.
Для подавления детрузорной гиперактивности в качестве первой линии терапии применяются антихолинергические средства, в дополнение к которым можно назначать препараты из группы бета-3-адреномиметиков [15]. Вторая линия лечения включает инъекционное введение в стенку мочевого пузыря 200 ЕД ботулинического нейропептида. Надо понимать, что терапия направлена на создание низкого внутрипузырного давления в мочевом пузыре, необходимого для нормальной работы верхних мочевых путей. Одним из результатов купирования гиперактивности, особенно при сохранении нормального или повышенного тонуса поперечно-полосатого сфинктера уретры, будет увеличение количества остаточной мочи или отсутствие мочевыделения. Поэтому крайне важно объяснить пациенту необходимость проведения указанной терапии с назначением периодической катетеризации мочевого пузыря.
При своевременной коррекции нарушений мочеиспускания у спинальных пациентов, применении рекомендованного метода отведения мочи, компенсации избыточного внутрипузырного давления вследствие гиперактивности детрузора или детрузорно-сфинктерной диссинергии удается избежать многих вторичных осложнений.
В комплексной программе реабилитационного лечения пациентов с травмой позвоночника и спинного мозга используются методики немедикаментозной коррекции, показавшие различный терапевтический потенциал в ходе исследований. В частности, применение электростимуляции мочевого пузыря с помощью имплантируемых электродов в работе А.В. Лившица и соавт. показало, что создать управляемый акт мочеиспускания невозможно, т. к. возбуждение детрузора распространяется на внутренний сфинктер уретры, моделируя детрузорно-сфинктерную диссинергию [16]. Несмотря на то что исследователи представили некоторые положительные результаты, методика не нашла клинического применения в связи с высокой инвазивностью и риском вторичных осложнений.
Применение электростимуляции переменным пульсирующим током по лонно-сакральной методике и электрофореза с прозерином на передней брюшной стенке в проекции мочевого пузыря в настоящий момент представляется несостоятельным вследствие особенностей физиологии нижних мочевых путей и неучастия мышц живота в акте мочеиспускания.
Перспективно использование современных методик: сакральной инвазивной электронейростимуляции с помощью имплантируемых электродов и ритмической периферической магнитной стимуляции в области сакрального центра мочеиспускания и крестцовых корешков [17, 18]. В настоящее время механизм действия магнитной стимуляции на физиологию нижних мочевых путей остается неясным. Многоступенчатость и сложность нервной регуляции процесса удержания мочи и акта мочеиспускания предполагают возможность вовлечения различных структур в ответ на внешнее воздействие. Клинические и уродинамические эффекты магнитной стимуляции, вероятно, связаны с восстановлением интеграции регуляторных рефлексов, при этом наблюдается эффект нейромодуляции, когда происходит изменение активности (торможение или возбуждение) структур центральной, периферической и вегетативной нервных систем [19, 20].
Нейрогенное нарушение мочеиспускания, обусловленное травмой позвоночника и спинного мозга, клинически чрезвычайно гетерогенно вследствие вариабельности уровня и степени тяжести поражения [21, 22]. Этот аспект диктует необходимость индивидуального диагностического подхода, выбора адекватного метода коррекции работы нижних мочевых путей. Реабилитационный путь спинального пациента в настоящее время невозможно представить без тесного сотрудничества невролога и уролога. Совместный современный подход специалистов к проблеме урологических осложнений травмы спинного мозга обеспечивает пациенту верное понимание собственного состояния и адекватную прогностическую оценку, а также возможность социальной адаптации и повышения качества жизни [23, 24].
Источник
Операция при недержании мочи – это серьезное хирургическое вмешательство. Когда врач направляет женщину на такую процедуру, он обязан осведомить ее обо всех возможных осложнениях процедуры, а также о том, что существует вероятность рецидива имеющейся проблемы.
Чтобы избавить женщину от стрессового недержания мочи, современная хирургия предлагает более 250 видов различных операций. Их цель – либо полностью компенсировать, либо откорректировать ту причину, которая привела к невозможности сдерживания мочи. Что касается эффективности подобных вмешательств, то показатели варьируются в пределах 70-95%.
При недержании мочи могут быть проведены следующие виды оперативного вмешательства:
Слинговые операции (подвешивающие операции);
Пластика влагалища;
Установка искусственного сфинктера;
Введение инъекций объемообразующих веществ в периуретральную зону.
Содержание:
- Показания к операции
- Слинговая операция при недержании мочи у женщин (TVT)
- Передняя кольпорафия
- Лапароскопическая кольпосуспензия по Burch
- Имплантация искусственного сфинктера мочевого пузыря
- Периуретральные инъекции объемообразующих препаратов
- Стоимость операции
- Отзывы
Показания к операции
Показания к оперативному вмешательству при недержании мочи можно назвать следующие:
Приобретенное стрессовое недержание.
Смешанная инконтиненция мочи с преобладанием стрессового компонента.
Быстрое прогрессирование патологии.
Неэффективность консервативной терапии у больных со второй и третьей степенью инконтиненции.
Слинговая операция при недержании мочи у женщин (TVT)
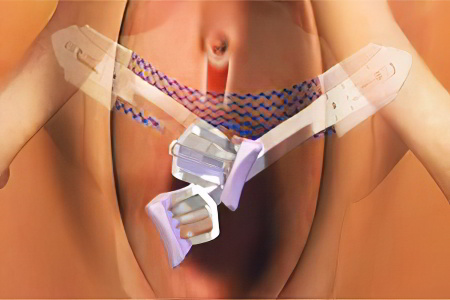
Эффективным и безопасным методом лечения стрессового недержания мочи являются слинговые операции (TVT и TVT-O). Они относятся к малоинвазивным методикам, которые проводятся под контролем современного оборудования. Суть вмешательства сводится к тому, что под среднюю часть мочеиспускательного канала вводится петля, которая призвана поддерживать уретру и не давать моче вытекать при напряжении. Петля выполнена из синтетического материала и размещается в пространстве между мочеиспускательным каналом и передней влагалищной стенкой. В итоге, угол наклона между мочевым пузырем и мочеиспускательным каналом восстанавливается, и моча не вытекает.
Слинговая операция проводится при стрессовом недержании мочи, а также при сочетании стрессового недержания с ургентным. То есть в тех случаях, когда неконтролируемый выход мочи сопровождается повышением внутрибрюшного давления (это происходит при чихании, смехе, кашле и т. д.).
Противопоказаниями к проведению данного вида хирургического вмешательства являются:
Период вынашивания ребенка.
Этап планирования беременности.
Инфекционно-воспалительные заболевания органов мочеполовой системы.
Прием лекарственных средств, разжижающих кровь менее чем за 10 дней до начала оперативного вмешательства.
Слинговая операция может быть реализована даже при условии того, что предшествующее хирургическое лечение не увенчалось успехом.
Перед тем как пациентку направят на операцию, она должна пройти комплексное уродинамическое обследование.
Что касается альтернативы слинговой операции, то при легкой степени недержания мочи могут помочь специальные упражнения. Однако, когда консервативная терапия оказывается неэффективной, то избавиться от имеющейся проблемы иными способами не удастся. Возможна также установка мини петель (miniTVT), транобтураторных петель(TOT) и безыгольчатых петель (needleless).
Когда у женщины параллельно наблюдаются иные патологии, например, выпадение тазового дна, то возможна установка сетки, а не небольшого петлевого имплантата. Если недержание мочи имеет смешанный характер, то параллельно проводится медикаментозная коррекция. То есть, императивную причину устраняют с помощью лекарств, а стрессовое недержание с помощью хирургического вмешательства.
Подготовка к операции проходит в несколько этапов:
Консультация специалистов: уролог, терапевт, анестезиолог, гинеколог. Если имеются какие-либо воспалительные процессы, то они подлежат лечению.
Госпитализация в стационар накануне оперативного вмешательства, сдача анализов и оценка состояния пациентки.
Осмотр анестезиологом, назначение премедикации.
Постановка клизмы перед оперативным вмешательством, либо прием слабительных препаратов с целью очищения кишечника.
Выбривание зоны лобка и наружных половых органов.
Отказаться от приема пищи и любой жидкости следует накануне операции.
Ход оперативного вмешательства:
Пациентке вводят спинальный наркоз, при котором сознание сохраняется, но чувствительность тела ниже поясницы пропадает.
На передней стенке влагалища делают разрез и формируют туннели для прохода и установки пели.
Через туннели проводится петля, ее боковые концы выводятся наружу. Центральная часть петли будет располагаться под мочеиспускательным каналом.
Хирург натягивает петлю до того момента, пока канал не соприкоснется с мочевым пузырем.
Путем наполнения мочевого пузыря проверяют нормальную степень удержания мочи.
Боковые части петли удаляют.
Разрез над влагалищем ушивают.
В мочевой пузырь устанавливают катетер.
Во влагалище устанавливают тампон.
Как правило, осложнения после перенесенной операции развиваются крайне редко. Возможно во время ее проведения перфорация мочевого пузыря. В этом случае повреждение ушивают, а катетер устанавливают на срок от 5 до 10 дней. Иногда в ранний послеоперационный период возникает повышение температуры тела и появляются незначительные боли в области разреза.
Что касается отдаленного послеоперационного периода, то не исключено, что от недержания мочи полноценно избавиться не удастся, либо, мочеиспускание может быть затруднено.
Осложнениями анестезии являются: головные боли, тошнота. Эти негативные явления самостоятельно проходят через 5-7 дней.
Передняя кольпорафия
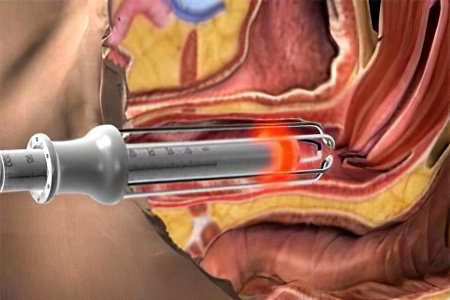
Передняя кольпорафия – это оперативное вмешательство, которое направлено на устранение недержания мочи у женщин. Во время проведения операции рассекают переднюю стенку влагалища, выделяют мочевой пузырь и уретру, затем влагалище вновь ушивают. При этом его стенки как бы стягивают, что позволяет стабилизировать уретру и шейку мочевого пузыря. Само влагалище также оказывается укреплено.
Эта операция сопряжена с риском фиброза тканей влагалища. Кроме того, эффект от ее проведения сложно назвать стабильным, а частота неудачных исходов вмешательства довольно высока.
Кольпорафию не рекомендуют женщинам, которые страдают только от стрессового недержания мочи, на фоне отсутствия иных патологий.
Лапароскопическая кольпосуспензия по Burch
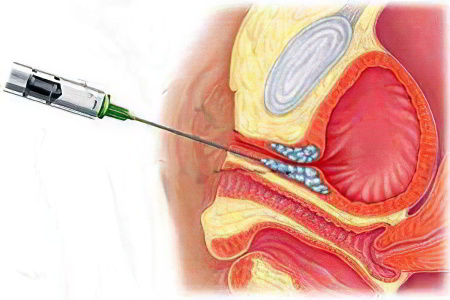
Кольпосуспензия по Берчу сводится к подвешиванию тканей, которые окружают мочеиспускательный канал. Подвешивают их к паховым связкам, которые располагаются на передней брюшной стенке и являются очень прочными.
Доступ получают через разрез в животе. Операция может быть открытого и закрытого типа. Последняя проводится с применением лапароскопического оборудования.
На протяжении многих лет кольпосуспензия по Берчу применялась для лечения стрессового недержания мочи у женщин в подавляющем большинстве случаев. Эффективность такой процедуры составляла до 70-80%.
Что касается недостатков методики, то среди них можно выделить: необходимость введения общего наркоза, подключение пациентки к аппарату искусственной вентиляции легких. Кроме того, чтобы процедура завершилась успехом, ее должен был проводить хирург, имеющий высокую квалификацию. Стоит отметить, что слинговые операции на данный момент времени практически вытеснили кольпосуспензию по Берчу, так как являются более безопасными и эффективными методиками лечения недержания мочи у женщин.
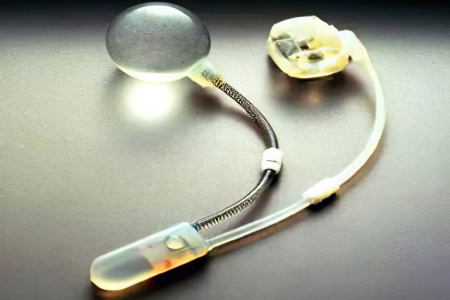
Имплантация искусственного сфинктера мочевого пузыря
Недержание мочи отрицательным образом отражается на качестве жизни любого человека, так как ее непроизвольное подтекание всегда доставляет массу неудобств. От различных форм недержания мочи страдает от 5 до 10% всего населения мира, причем 70% из них – это женщины.
Недержание мочи может быть ургентным или нейрогенным. В этом случае у человека наблюдается повышенная сократимость мочевого пузыря, а также механизм удержания жидкости в нем оказывается нарушен. Это может возникать по причине недостаточности работы сфинктера мочевого пузыря.
Отдельно выделяют стрессовое недержание мочи, которое связано с истинной недостаточностью сфинктера. Его классифицируют как третий тип стрессового недержания мочи (классификация Международного Общества по удержанию мочи).
Известно, что не более 50% людей обращаются по поводу имеющейся у них проблемы за квалифицированной врачебной помощью. Часто это происходит из-за ложного чувства стыда, либо из-за неверного убеждения о невозможности терапии. Как правило, от того момента, когда человек впервые испытал недержание мочи и до его обращения к специалисту проходит в среднем 5 лет. Между тем, современная медицина располагает эффективными методами лечения недержания и способна помочь практически каждому человеку с данной проблемой.
Ургентное недержание лечится чаще всего с помощью лекарственных препаратов, а вот стрессовое недержание мочи третьего типа всегда требует проведения операции. Одним из ведущих методов хирургического вмешательства является имплантация искусственного сфинктера мочевого пузыря.
Что такое искусственный сфинктер мочевого пузыря? Искусственный сфинктер – это протез, который вживляют в тело человека. Он необходим для удержания мочи в том случае, когда собственный сфинктер с этой задачей не справляется.
Когда и для чего он был создан? Первый прототип современного устройства был разработан еще в 47 году прошлого века ученым и врачом-урологом F. B. Foley. Он имел вид манжетки, которую располагали вокруг уретры человека. Эта манжетка соединялась со шприцом-помпой, которую хранили в кармане нижнего белья. Идея была весьма инновационной и верной с медицинской точки зрения. Однако, уровень хирургии того времени не позволял полностью убрать имплант в тело человека, поэтому его установка часто осложнялась гнойными процессами.
В 72 году прошлого века устройство было усовершенствовано урологом F. B. Scott. Именно этот американский врач создал прототип современного искусственного сфинктера. Он состоял из трех элементов: манжетки, которая обхватывала и сжимала уретру, двух помп, которые надували и сдували ее, а также резервуара для сбора жидкости. Успех оперативного вмешательства по установке первого трехкомпонентного сфинктера в те времена достигал 60%.
В дальнейшем прибор был усовершенствован компанией American Medical System, что произошло еще в 83 году. До настоящего времени врачи с успехом применяют именно искусственные сфинктеры AMS, которые прошли лишь незначительные доработки.
Эффективность операции. Успех установки современного искусственного сфинктера мочевого пузыря приравнивается к 75%. Причем 90% людей, которые пользуются этими приборами, абсолютно удовлетворены их работой. Не более чем в 20% случаев требуется повторная операция, которая проводится для того, чтобы устранить недостатки в работе устройства.
Показания и противопоказания. Показания к установке искусственного сфинктера мочевого пузыря различаются. Абсолютным показанием является необратимые нарушения в работе собственного сфинктера, на фоне нормальной работы мочевого пузыря. При этом у пациента не должно быть инфекции мочевых путей, и нарушения проходимости уретры.
У мужчин и женщин можно выделить различные показания к проведению операции, которые представлены в таблице.
Мужчины | Женщины |
Если недержание мочи развивается на фоне перенесенной радикальной простатэктомии по причине рака простаты. | Недержание мочи нейрогенного характера на фоне травмы, болезни головного или спинного мозга, миеломенингоцеле, сакрального генезиса, периферической нейропатии. |
Перенесенная травма таза, реконструкция стриктуры уретры, проведенная оперативным путем. | Стрессовое недержание мочи третьего типа, от которого не удалось избавиться с помощью менее инвазивных процедур. |
Пороки развития шейки уретры и мочевого пузыря врожденного характера. | |
Нейрогенная дисфункция сфинктера мочевого пузыря на фоне травмы головного мозга или по причине врожденных пороков развития. |
Абсолютными противопоказаниями к проведению операции являются:
Стриктурная болезнь уретры.
Рецидив стриктуры.
Инфекции мочевых путей.
Дивертикулы уретры.
Нестабильный или гиперактивный мочевой пузырь.
Сморщенный мочевой пузырь.
Низкий объем мочевого пузыря.
К относительным противопоказаниям относятся:
Пузырно-мочеточниковый заброс второй стадии и выше.
Мочекаменная болезнь, рак мочевого пузыря и иные состояния, которые требуют хирургического лечения.
Стеноз шейки мочевого пузыря, его контрактура.
Если удается устранить относительные противопоказания, то установка искусственного сфинктера становится возможной. Важно, чтобы человек обладал необходимыми умственными и физическими способностями, которые позволяли бы ему контролировать работу помпы. Перед проведением операции обязательна подробная консультация у врача по поводу всех нюансов работы со сфинктером.
Какие нужно пройти обследования перед операцией имплантации сфинктера мочевого пузыря? Во-первых, пациент обсуждает с врачом все нюансы предстоящего вмешательства. Во-вторых, он проходит физикальное обследование, которое направлено на выявление показаний и противопоказаний к операции.
В обязательном порядке нужно сдать общий анализ мочи, посев мочи, анализы крови, возможно прохождение ЭКГ.
В ряде случаев требуется прохождение цистографии, уретрографии, уретроскопии, цистоскопии и иных узкоспециализированных тестов. Чем качественнее будет обследован пациент, тем выше шанс того, что операция пройдет успешно.
Ход операции. Операция может быть проведена через угол полового члена и мошонки (пеноскротальный доступ), либо через промежностный разрез (выполняется под мошонкой). Если доступ пеноскротальный, то для установки импланта достаточно одного разреза. Если доступ промежностный, то требуется выполнение дополнительного разреза, чтобы установить резервуар. Пациент в этом случае проводит в больнице от 1 до 3 дней. Катетер из уретры будет убран уже на следующие сутки после операции.
Активируют сфинктер после его установки спустя 6 недель. Это время необходимо для того, чтобы он прижился. Под контролем уролога человек обучается работе с прибором. Посещать врача в дальнейшем потребуется один раз в год.
Периуретральные инъекции объемообразующих препаратов

Периуретральные инъекции осуществляют путем введения в пространство вокруг уретры различных биологических и синтетических препаратов. В итоге, как бы создается дополнительный наружный сфинктер, который сужает мочевой канал и препятствует вытеканию мочи. Эта процедура является самой малотравматичной для пациента.
Показанием к инъекции является недостаточность сфинктера. Процедуру проводят под местным наркозом. Чаще всего ее назначают тем женщинам, которые отказываются от операции более инвазивными методами.
Главным недостатком процедуры является рецидив недержания мочи, который случается спустя 1-2 года. После введения вещества в месте инъекции возникает ощутимая болезненность. Кроме того, возможна задержка мочи и нарушения в опорожнении мочевого пузыря.
Европейская ассоциация урологов признает периуретральные инъекции эффективным методом устранения недержания мочи у женщин, но специалисты отмечают временный эффект от проведения процедуры. В ряде случаев он может продлиться не более 3 месяцев. Поэтому инъекцию нужно будет вводить вновь. Слинговая операция является более результативной по сравнению с данным методом лечения.
Стоимость операции

Некоторые операции могут быть проведены по государственным квотам. Для их получения нужно подать заявку и дождаться очереди.
Под квоты попадают:
Слинговые операции.
Полостные абдоминальные и лапароскопические операции.
Установка протезов сфинктеров мужчинам (н?
