Заболевания позвоночника в практике терапевта
В статье проведено обобщение современных подходов к диагностике и лечению синдрома боли в спине на уровне амбулаторной терапевтической службы. Приведены алгоритмы стандартных и минимально необходимых диагностических манипуляций, очерчены показания для назначения консультаций смежных специалистов.
Введение
Синдром боли в спине остается одной из самых частых причин обращения к врачу как в нашей стране, так и за рубежом [1, 2]. Согласно последним эпидемиологическим исследованиям, в течение жизни боль в спине возникает у 70–90% населения, преимущественно у людей трудоспособного возраста, а у 20–25% регистрируется ежегодно [3]. Глобальное исследование заболеваемости населения (Global Burden of Disease Study) признало боль в спине главной причиной нетрудоспособности в мире [4]. Боль в нижней части спины (БНС) является одной из самых частых причин обращения к врачам самых разных специальностей. Европейское многоцентровое исследование продемонстрировало, что хронической болью страдает более 20% жителей Европы, при этом большинство пациентов испытывало боль именно в нижней части спины [5].
При этом на терапевтическое звено оказания медицинской помощи падает наибольшая нагрузка по работе с данной категорией пациентов. Согласно опросу, проведенному Всероссийским центром изучения общественного мнения (ВЦИОМ) в ноябре 2017 г., охватившему более 700 жителей РФ трудоспособного возраста (от 22 до 45 лет), испытывавших боли в спине в настоящее время или в течение последнего года, выявлено, что более 1/3 из них обращались именно к терапевту с жалобами на боли в спине (рис. 1).
Диагностический поиск при БНС
Очевидно, что боль как патологический феномен является целой цепью изменений на разных уровнях организма [2]. Поначалу защитный механизм, сигнализирующий о проблеме, позднее становится серьезным и, подчас, самостоятельным страданием. Как писал еще Авиценна: «Боль помогает врачу распознать заболевание, нередко указывая правильный путь лечения. Такая боль приносит пользу, подобно огню, когда он согревает, а не сжигает; подобно воде, когда она орошает, а не затопляет, подобно ветру, когда он освежает, а не разрушает».
Поэтому задачи терапевтической службы — не столько постановка точного топического диагноза, сколько скрининг и анализ основных жалоб и симптомов, исключение серьезной патологии (так называемых «красных флагов»), назначение противоболевой терапии, которая сама по себе может дать подсказки о причине развития болевого синдрома, и при необходимости направление пациента к узкому специалисту для уточнения диагноза [1, 3].
БНС характеризуют как боль, мышечное напряжение и/или скованность, локализующиеся между нижней парой ребер и ягодичными складками с иррадиацией в нижние конечности или без таковой. Доброкачественная скелетно-мышечная боль в спине не считается нозологической единицей. Высокая распространенность и частое отсутствие конкретной объективно визуализируемой анатомической причины заставили выделить синдром БНС в МКБ-10 в качестве регистрационной, а не нозологической категории М 54.5. Для этой формы БНС не выявлено связи между тяжестью морфологических изменений позвоночника (по данным компьютерной и магнитно-резонансной томографии) и выраженностью боли в спине. Так, явная патология межпозвонковых дисков зачастую обнаруживается у практически здоровых людей, при этом выявление патологических изменений в межпозвонковых дисках не приводит к развитию боли в спине в дальнейшем [2, 3, 5].
С практической точки зрения удобно выделять 3 основные причины болей в спине.
Неспецифическая боль в спине (частота встречаемости — 85–90%). Этот термин означает, что не удалось выявить серьезную патологию (заболевание), явившуюся причиной боли: инфекцию, травму, воспаление, опухоль, остеопороз, ревматоидный артрит, анкилозирующий спондилит, заболевание соединительной ткани и др. Помимо этого, должны отсутствовать специфические признаки вовлечения в процесс корешков спинномозговых нервов (радикулопатия — 1–5%, синдром конского хвоста — до 2%) и стеноза спинномозгового канала.
Специфические причины (частота встречаемости 4–7%):
перелом позвоночника;
первичные и метастатические опухоли позвоночника;
миеломная болезнь;
спондилоартрит;
остеомиелит;
эпидурит;
сирингомиелия;
опухоли спинного мозга и спинномозговых корешков;
заболевания внутренних органов.
Боль, вызванная компрессионной радикулопатией, стенозом поясничного канала (частота встречаемости — 7%).
С учетом того, что большинство заболеваний внутренних органов находятся в сфере ответственности терапевта, становится ясно, что именно этому врачу чаще всего приходится решать проблему болей в спине.
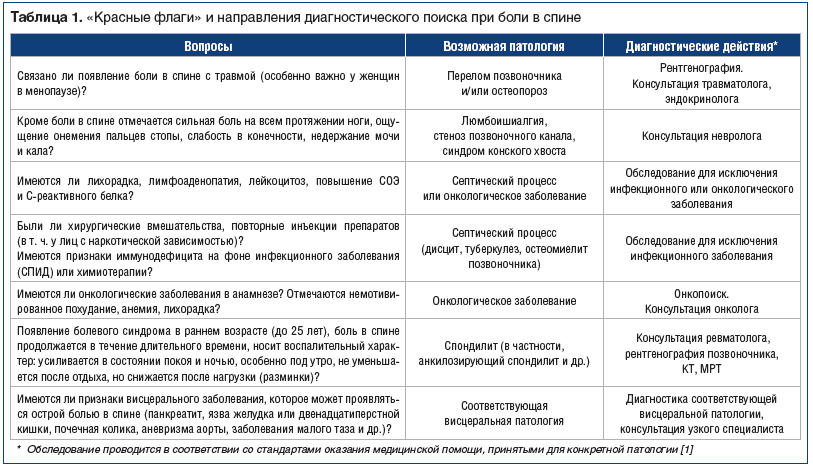
В помощь терапевтам разработаны относительно простые диагностические алгоритмы и опросники [3, 6]. Не требующий специальных инструментов, простой, но скрупулезный диагностический поиск позволяет уже на амбулаторном терапевтическом приеме не только верифицировать самые распространенные причины болевого синдрома, но и заподозрить серьезные заболевания, требующие неотложных мер, диагностических процедур, направления к узким специалистам (табл. 1).
Минимальный лабораторный диагностический набор состоит из анализа крови и мочи, оценки скорости клубочковой фильтрации, концентраций глюкозы и — при возможности — высокоточной оценки С-реактивного белка.
Минимальный инструментально-диагностический набор состоит из измерения артериального давления, ЭКГ, рент-
геновского исследования органов грудной клетки и УЗИ
органов брюшной полости и забрюшинного пространства.
Алгоритм действий врача-терапевта представлен на рисунке 2.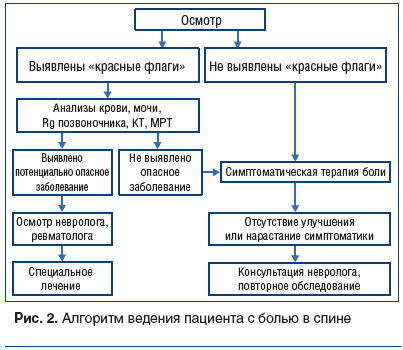
Терапия боли в спине
Сложности в достижении адекватного обезболивания в рутинной практике определяются упомянутой выше коморбидностью, неизбежной полипрагмазией и необходимостью долгосрочной терапии болевого синдрома [7, 8]. У коморбидных пациентов с целой палитрой соматических заболеваний предпочтительным критерием выбора становится безопасность лекарственного препарата и безопасность лекарственного взаимодействия.
Проведенные эпидемиологические исследования показывают, что не более чем у 20% пациентов удается обеспечить адекватное обезболивание. Это связано с использованием недостаточно эффективных либо устаревших лекарств, необоснованных схем применения, рефрактерностью у пациентов, часто использующих анальгетики, нежелательными побочными реакциями и др. [8].
У большинства пациентов проводимая терапия эффективно купирует боли в течение 4 нед. Однако почти у 73% больных в течение первого года наблюдения развивается как минимум одно обострение [7]. Также отмечено, что 20–25% больных продолжают испытывать боль в спине, т. е. страдание становится хроническим, что приводит к существенному возрастанию нагрузки и на органы здравоохранения, и на бюджет в целом: на эту когорту больных тратится до 80% средств здравоохранения [7].
Самым частым средством купирования как острых, так и хронических болевых синдромов в отечественной и мировой практике являются нестероидные противовоспалительные препараты (НПВП). Это корреспондирует и с Рекомендациями по ведению хронической боли [9]. Ключевыми препаратами они остаются и при лечении болей в спине [10]. Выбор НПВП должен быть обдуманным и взвешенным, с оценкой соотношения риска и пользы конкретного препарата.
Чем в основном определяется сегодня безопасность терапии НПВП? Ответ, очевидно, лежит в области коморбидности пациентов, отмечаемой в последнее время не только у пожилых, но и у относительно молодых больных. Так, риск повреждения слизистой оболочки органов желудочно-кишечного тракта (в т. ч. НПВП-гастропатии) есть у большинства пациентов отделений кардиологии, терапии, гастроэнтерологии. Причем кровотечения, связанные с собственно язвенной болезнью, составляют лишь небольшую часть всех желудочно-кишечных кровотечений (ЖКК) в структуре смертельных осложнений, явившихся причиной летального исхода [11]. При безальтернативности применения НПВП при болевых синдромах одной из основных задач менеджмента боли остается выбор правильного препарата и его лекарственной формы [10, 11].
Понимание различной роли изоформ циклооксигеназы (ЦОГ) в механизмах воспаления и генезе побочных эффектов препаратов НПВП привело к разработке и внедрению в широкую клиническую практику наряду с «классическими» и относительно селективных и высокоселективных ЦОГ-2 ингибиторов. Эти препараты имеют лучший профиль гастроэнтерологической безопасности. Однако практика их применения сопровождается сообщениями о кардиоваскулярных рисках высокоселективных ЦОГ-2 ингибиторов. Результаты клинического исследования VIGOR, в котором проводилось сопоставление эффективности и безопасности напроксена и рофекоксиба в симптоматической терапии ревматоидного артрита, показали, что при более низкой частоте желудочно-кишечных побочных эффектов у пациентов, получавших рофекоксиб, частота инфаркта миокарда в этой группе составила 0,4% в сравнении с 0,1% у пациентов группы напроксена [12]. Существенное увеличение риска кардиоваскулярных катастроф при использовании рофекоксиба было получено и в исследовании APPROVe [13]. Поэтому интерес исследователей и клиницистов при применении НПВП при острой и хронической боли смещается к препаратам со сбалансированной активностью в отношении ЦОГ [14]. Особенно это важно для коморбидных пациентов, т. к. сердечно-
сосудистые заболевания и поражения ЖКТ относятся к самым частым вариантам коморбидности.
Представителем НПВП, обладающим благоприятным профилем ингибирования активности ЦОГ, является ибупрофен, считающийся и одним из наиболее изученных анальгетиков в группе НПВП. При лечении сильных болевых синдромов, требующих быстрого купирования, перспективной оказалась комбинация ибупрофена с парацетамолом, обеспечивающая потенцирование действия обоих компонентов, возможность снижения дозировок с минимизацией риска побочных эффектов [15]. Оценка рисков развития желудочно-кишечных осложнений при терапии различными НПВП проведена в исследованиях J. Castellsague et al., А.Е. Каратеева и др., результаты приведены на рисунке 3 [16, 17].
Риски сердечно-сосудистых осложнений при терапии различными НПВП оценены в исследовании С. Varas-Lorenzo et al. (2013), результаты приведены на рисунке 4 [18].
Собственная анальгетическая эффективность предлагаемой комбинации (ибупрофен 200 мг + парацетамол 500 мг, например, препарат Нурофен Лонг) превосходит эффективность монокомпонентных НПВП и даже комбинированных препаратов, содержащих кодеин (рис. 5, 6) [19]. Эта комбинация и в одинарной, и в двойной дозе (ибупрофен 400 мг + парацетамол 1000 мг) имеет самый низкий коэффициент NNT, превосходя по эффективности диклофенак и декскетопрофен [20].
![Рис. 6. Сравнительная эффективность комбинированных анальгетиков [19] Рис. 6. Сравнительная эффективность комбинированных анальгетиков [19]](https://www.rmj.ru/upload/medialibrary/9da/13-7.png)
Двойное слепое плацебо-контролируемое рандомизированное исследование S.E. Daniels et al. (n=600) показало, что комбинация ибупрофен 200 мг + парацетамол 500 мг, содержащаяся в препарате Нурофен Лонг, обеспечивает сопоставимое и даже более эффективное обезболивание, чем комбинированные кодеинсодержащие препараты [19].
Современная технология Synchro-Tech™ позволяет быстро высвобождать компоненты препарата, при этом эффективный обезболивающий эффект развивается уже к 15-й мин, достигает максимума к 40 мин и продолжается до 8 ч. Клинически важным оказывается и наличие противовоспалительного эффекта препарата Нурофен Лонг, реализуемого за счет нескольких механизмов: ингибирования ЦОГ, снижения выработки простагландинов на центральном уровне регуляции, уменьшения выработки провоспалительных медиаторов на локальном уровне, ингибирования миграции лейкоцитов в очаг воспаления.
Терапия болевого синдрома в спине может требовать дополнительного назначения и препаратов, содержащих витамины группы В, миорелаксантов, применения аппаратных методов лечения, физиотерапии, когнитивно-поведенческой терапии, которую ряд исследователей относит к первостепенным подходам. При всей обоснованности этих рекомендаций именно успешность (скорость и мощность) обезболивания определяет впечатление пациента от назначений врача, формирует уровень доверия и повышает комплаентность, что в конечном итоге служит залогом эффективности терапии.
Заключение
Лечением болевых синдромов в спине занимаются врачи разных специальностей, однако в первую очередь такие пациенты обращаются на амбулаторный прием к врачутерапевту. Этот синдром требует вдумчивой диагностики и терпеливого подхода к терапии с использованием современных лекарственных средств и немедикаментозных подходов.
Источник
Эти требования особенно высоки в клинике внутренних болезней, поскольку планирование тактики ведения пациента определяется не только традиционной последовательностью «диагноз – лечение», но и сложнейшей задачей выбора определенной группы лекарственных препаратов из арсенала патогенетических средств. Не менее важно решение вопроса о безопасности фармакотерапии с учетом известного фармакологического действия лекарства, его возможного влияния на сопутствующие и/или конкурирующие заболевания, совместимость с другими препаратами, назначаемыми для их лечения.
Важность таких требований обусловлена изменениями демографической ситуации во многих странах мира. Старение организма человека начинается уже с 40–50–летнего возраста [Ю.С. Пименов, 1995]. Процесс старения человека – процесс физиологический, однако он сопровождается нарастающими с возрастом нарушениями структуры и функции многих органов и систем организма. Хотя старость – не болезнь (и не диагноз), однако не вызывает сомнения, что старение организма способствует возникновению и накоплению болезней. По прогнозам ученых, количество пожилых лиц в различных популяциях увеличивается в геометрической прогрессии: к 2040 году доля лиц старше 85 лет составит примерно 20%.
Современный пожилой больной представляет собой уникальный клинический феномен с точки зрения наличия и сочетания у него разнообразной по характеру и течению патологии, конкурирующей по своей прогностической значимости и влиянию на качество жизни. Конец ХХ века внес в нашу практику термин «Неизбежные спутники старения» [1]. Данное определение предложено Национальной академией наук США и включает в себя:
• деменцию
• остеоартроз (ОА)
• остеопороз
• перелом бедра
• ишемическую болезнь сердца
• инсульт
• сахарный диабет
• рак
Естественно, что перечень этих патологий отражает наиболее значимые, как правило, параллельные, в том числе инволютивные изменения в организме человека, в том числе со стороны сердечно–сосудистой и костно–суставной системы. Опыт показывает, что у лиц пожилого и старческого возраста при обследовании обнаруживается от трех до пяти различных заболеваний.
В 2005 году P. Caporali с соавт. при исследовании больных с ОА выявили у 52% из них наличие артериальной гипертонии, у 21% – остеопороз, у 15% – сахарный диабет 2 типа, у 12% – хронические обструктивные болезни легких, еще у 6% – ишемическую болезнь сердца, а у 5% – наличие пептической язвы. Wang P. с соавт. [2] при исследовании 13577 больных ОА показали, что 80% обследованных принимают антигипертензивные препараты [3]. Среди больных, лечившихся в Институте ревматологии с диагнозом ОА, артериальная гипертония диагностирована у 58%, а ишемическая болезнь сердца у 22,6% пациентов. По данным Лазебника Л.Б. и Дроздова В.Н., обследовавших больных с заболеваниями желудочно–кишечного тракта в возрасте от 60 до 85 лет (всего 564 человек), ОА определялся у 55,5% больных с хроническим холециститом, у 39% – с хроническим гастритом, у четверти больных с хроническим панкреатитом и немного реже при наличии язвенной болезни и цирроза печени (16,6 и 12,6% соответственно), а число болезней на одного больного составило 5,1–5,8.
Для изучения частоты ОА (коленного сустава) у больных терапевтического стационара (ГКБ №50, 81 г. Москвы) было скринировано 1200 больных с различными соматическими заболеваниями (326 мужчин, средний возраст которых составил 62,4±7,3 года, и 874 женщины, средний возраст – 63,6±8,7 года). 73,2% (878) обследованных в качестве основной или конкурирующей болезни имели кардиоваскулярную патологию (АГ, ИБС или их сочетание). Остеопороз (на основании двухфотонной абсорбциометрии дистального отдела предплечья) был диагностирован у 43,7% (524) пациентов.
Жалобы на боли в одном из крупных суставов (тазобедренном – 123 (10,3%) или коленном – 826 (68,8%)) предъявляли 75,1% (901 пациент), 63,1% из них отмечали утреннюю скованность, длящуюся не более 1 часа. Ограничение подвижности пораженного сустава и боль при ходьбе испытывали 54,3% больных. Средний бал болевого синдрома по индексу WOMAC составил 356,4±46,4 мм, средний бал функциональной недостаточности – 948,8±39,7мм.
Из 901 обследованного пациента рентгенологические признаки ОА (сужение суставной щели, остеофиты и/или субхондральный склероз и/или субхондральные кисты) обнаружены у 710 (59,2%) пациентов, причем у женщин несколько чаще, чем у мужчин [143 (43,9%) мужчины и 567 (64,9%) женщин]. На основании клинических и рентгенологических признаков ОА был диагностирован в 783 (65,3%) случаях.
Таким образом, клинический скрининг демонстрирует, что почти каждый второй больной с патологией внутренних органов имеет ОА, поэтому основной проблемой фармакотерапии ОА, несомненно, является рациональность и безопасность.
Поскольку самым ярким клиническим проявлением ОА является боль, приводящая к ухудшению качества жизни больных, первыми средствами, которые врач назначает больному наиболее часто, являются нестероидные противовоспалительные препараты (НПВП), что не вызывает сомнений в связи с наличием рекомендаций ревматологических ассоциаций различных стран и отличной доказательной базой эффективности при ОА ряда НПВП. Однако наличие других заболеваний и сопутствующая в связи с этим терапия повышают риск развития нежелательных явлений, особенно со стороны желудочно–кишечного тракта, почек и сердечно–сосудистой системы, а некоторые из них отрицательно влияют на метаболизм суставного хряща, особенно производные индол/инденуксусной кислоты (индометацин).
Вместе с тем, разрабатывая тактику ведения пациентов с ОА, каждый врач должен представлять, что одной обезболивающей терапии недостаточно для достижения стабилизации болезненного процесса. Только длительное лечение, направленное на улучшение функции основных тканей сустава, способно привести к стойкому обезболивающему эффекту и улучшению структур хрящевой ткани [Н.В. Чичасова, Е.Л. Насонов, 2004].
Данным требованиям отвечают симптоматические препараты медленного действия, для некоторых из них показана и структурно–модифицирующая эффективность. Наиболее изученными являются хондроитин сульфат (ХС) и глюкозамин сульфат (ГС). Более 20 контролируемых исследований симптом–модифицирующего действия ХС и ГС показало, что лечение хондропротекторами вызывает симптоматическое улучшение, сходное с другими «симптоматическими» препаратами («простые» анальгетики, НПВП), предотвращает прогрессирование структурных изменений, а безопасность препаратов не отличается от плацебо [4–15]. Последнее свойство чрезвычайно важно при лечении больных с сопутствующей патологией. Важным аспектом действия хондропротекторов является сохранение положительного эффекта после проведения полного курса лечения, в то время как после отмены быстродействующих средств боль и уменьшение функциональных возможностей больного быстро нарастают.
Учитывая результаты международного рандомизированного, двойного слепого плацебо–контролируемого исследования GAIT при интенсивном болевом синдроме, весьма полезной может оказаться комбинация ХС и глюкозамин гидрохлорида (ГГ). По данным, полученным в исследовании, эффективность комбинации ХС и ГС значимо отличалось от плацебо (р<0,002) у больных с выраженными болями в коленных суставах [16]. По–видимому, это обусловлено тем, что ХС и ГС оказывают разнообразное, но не совсем идентичное фармакологическое действие на различные структуры сустава, в том числе на метаболизм хряща, а при совместном применении дополняют и, возможно, усиливают действие друг друга.
Эффективность и безопасность применения комбинированной терапии ХС и ГС подтверждена результатами исследования, проведенного в Институте ревматологии РАМН и на кафедре ревматологии ФППО ММА имени И.М. Сеченова [7–19], в которое были включены 90 амбулаторных больных, половина из которых получали препарат АРТРА (500 мг ХС и 500 мг ГС) и диклофенак, остальные больные – только диклофенак. К 4–му месяцу лечения отмечены достоверно меньшие показатели боли у пациентов, получавших препарат АРТРА и диклофенак, по сравнению с больными, леченными только диклофенаком (р=0,008); эти различия сохранялись и через 3 месяца после отмены терапии. Важно подчеркнуть, что на фоне терапии препаратом АРТРА значительно уменьшилась потребность в приеме НПВП (диклофенак), через месяц лечения препарат был отменен у 4,5%, через 4 месяца – у 20%, а через 6 месяцев – у 40% больных. Отличительной особенностью АРТРА является его хорошая переносимостью и безопасность.
Другое исследование по изучению эффективности препарата АРТРА было проведено на кафедре клинической фармакологии и фармакотерапии МГМСУ [20–22].
В исследование вошли 60 больных, средний возраст которых составил 62,3±4,7 года, с ОА коленных суставов со ІІ–ІІI рентгенологической стадией заболевания (по Kellgren–Lawrence), выявленных во время скрининга, и с впервые диагностированным ОА.
Рандомизированно пациентов разделили на две группы по 30 человек. Больные были сопоставимы по возрасту, полу, распространенности отдельных терапевтических нозологий, интенсивности болевого синдрома и степени функциональных ограничений. На момент исследования ряд пациентов принимали НПВП, причем их число в группах было сопоставимо (табл. 1).
Больные 1–й группы получали препарат АРТРА по 1 таблетке 2 раза в сутки в течение трех первых недель и далее по 1 таблетке 1 раз в сутки в течение 6 месяцев. Эти больные продолжали получать ранее применяемые НПВП с последующим снижением дозы или полной отменой при исчезновении боли. Во 2–й группе – пациенты продолжали получать ранее назначенные НПВП, в ходе исследования доза НПВП менялась в зависимости от выраженности боли.
Эффективность терапии оценивалась через 1, 3 и 6 месяцев наблюдения по индексу WOMAC (боль, нарушение функции), скорости ходьбы на 15 метров. После окончания лечения больным предлагалось оценить эффективность терапии по критериям: плохо, удовлетворительно, хорошо, отлично.
Оценка влияния терапии на желудочно–кишечный тракт и сердечно–сосудистую систему проводилась по клиническим и инструментальным данным: ЭГДС, динамика уровня АД, Холтеровское мониторирование (частота болевой и безболевой ишемии миокарда), исходно и через 6 месяцев лечения. С целью оценки структурно модифицирующего эффекта АРТРА всем пациентам была выполнена МРТ коленного сустава на старте исследования и через 9 месяцев наблюдения. Исследование проводилось на магнитно–резонансном томографе «Sonata» фирмы «Siemens» с напряженностью магнитного поля 1,5 Тл. 2002 г. выпуска. Плоскости сканирования – фронтальная, сагиттальная. Толщина срезов 3–5 мм, расстояние между срезами 1 мм.
В качестве оценки изменений хрящевой структуры сустава проводилась оценка высоты суставного хряща в латеральных и медиальных срезах сустава в трех локализациях:
I локализация – передняя поверхность головки бедренной кости (хрящ бедренной кости);
II локализация – задняя поверхность головки бедренной кости (хрящ бедренной кости);
III локализация – точка наибольшего соприкосновения бедренной и большеберцовой костей (сумма толщины бедренной и большеберцовой кости).
Также оценивалась площадь суставной поверхности.
Оценка динамики боли по WOMAC продемонстрировала, что у пациентов, принимавших АРТРА, уже через 3 месяца терапии наблюдался больший регресс болевого синдрома по сравнению с группой контроля. Через 6 месяцев терапии у пациентов 1 группы интенсивность болевого синдрома была достоверно ниже, чем у пациентов 2 группы: 178,3±37,2 мм против 287,4±42,8 мм (р=0,02).
К концу терапии скорость ходьбы на 15 метров, выраженная в секундах, в 1 группе нарастала и составила 29,7 сек. против 39,6 сек. во второй группе (рис. 1).
Оценка функциональной недостаточности по шкале WOMAC на старте исследования не выявила значимых различий между группами наблюдения (рис. 2). В обеих группах через 6 месяцев терапии мы наблюдали достоверное снижение индекса функциональной недостаточности, более выраженное в первой группе по сравнению с группой контроля (427,3 и 658,9 мм (р=0,002) соответственно).
Таким образом, на фоне приема АРТРА отмечались достоверное уменьшение болевого синдрома и улучшение функциональной способности суставов.
Визуальная оценка сустава по МРТ до лечения и через 9 месяцев наблюдения выявила наличие положительной динамики у 60% больных, леченных АРТРА, отсутствие динамики наблюдалось у 30%, а нарастание изменений фиксировалось у 10% больных. В контрольной группе отрицательная динамика отмечена у 63,3% пациентов и у 36,7% картина МРТ изображения осталась прежней. Анализ высоты суставного хряща в латеральном срезе у пациентов, принимавших АРТРА, продемонстрировал положительную динамику во всех точках подсчета, площадь суставной поверхности за период наблюдения увеличилась в среднем на 40 мм? (рис. 3). В противоположность этому во второй группе, где пациенты принимали только НПВП, в 1 и 2 локализации отмечена отрицательная динамика, площадь суставной поверхности уменьшилась в среднем на 6 мм. Анализ высоты суставного хряща в медиальном срезе показал аналогичные результаты в группах.
Таким образом, больший положительный эффект с позиций клинической картины в группе пациентов, получающих АРТРА, подтвержден данными МРТ исследования, которое выявило увеличение площади суставной поверхности и прирост высоты хряща в исследуемых точках.
С практической точки зрения в оценке эффективности и безопасности терапии ОА у пациентов с соматической патологией чрезвычайно важна динамика суточной потребности в НПВП, частота развития нежелательных явлений со стороны ЖКТ. Динамика потребности в НПВП и частота НПВП–гастропатий (эрозивно–язвенное поражение слизистой оболочки верхнего отдела ЖКТ) представлены в таблице 2.
Как видно из таблицы 2, в группе больных, принимавших АРТРА, к концу лечения только 23,3% пациентов нуждались в дополнительном приеме НПВП против 73,3% в группе контроля, что, по–видимому, и повлияло на более низкую частоту у них случаев НПВП–гастропатии. Случаи НПВП–гастропатии в группе больных, получавших АРТРА, выявлены лишь у 20% пациентов против 43,3% в группе пациентов, получавших только НПВП.
Таким образом, включение в терапию ОА препарата АРТРА обеспечивает снижение дозы или отмену сопутствующих НПВП и в 2 раза снижает вероятность развития нежелательных побочных явлений со стороны ЖКТ.
При оценке эффективности терапии больными 1–й группы большинство из них расценили ее как отличную и хорошую (83,3%), в то время как больные контрольной группы чаще указывали на удовлетворительный и плохой эффект (70%).
Одной из задач исследования явилась оценка состояния сердечно–сосудистой системы у пациентов с ОА на фоне лечения. Изучение динамики САД показало наличие положительной динамики у пациентов І группы по сравнению со 2–й (разница среднесуточного САД до начала терапии и через 6 месяцев наблюдения составила 7,3 мм рт.ст. и 3,6 мм рт.ст. соответственно; р>0,05) (рис. 4).
Частота болевой и безболевой ишемии миокарда по данным Холтеровского мониторирования (через 6 месяцев лечения) также оказалась меньшей в группе больных, получавших АРТРА (в І группе в среднем суммарно 3,7 приступов на группу, во ІІ – 6,3) (рис. 5).
Интересным результатом наблюдения за пациентами оказалась частота госпитализаций по любому поводу, включая дестабилизацию основного заболевания, как показатель клинической и фармакоэкономической эффективности включения в схему лечения пациентов с ОА и соматической патологией хондропротекторов (АРТРА): частота повторных госпитализаций в группе больных, получавших АРТРА, была значительно меньше, чем в группе пациентов, получавших только НПВП. Так, в 1–й группе в течение 9 месяцев наблюдения было 16 госпитализаций у 13 пациентов, тогда как во 2–й группе число госпитализаций составило 38 у 23 пациентов.
Таким образом, включение препарата АРТРА в терапию пациентов с остеоартрозом и хроническими терапевтическими заболеваниями позволяет:
• уменьшить боль и улучшить функциональное состояние суставов;
• улучшить состояние тканей пораженного сустава (по данным МРТ);
• обеспечить высокую эффективность лечения при минимальном риске развития побочных эффектов и неблагоприятных лекарственных взаимодействий;
• снизить риск осложнений фармакотерапии ОА (со стороны ЖКТ и сердечно–сосудистой системы);
• снизить риск дестабилизации соматической патологии (ИБС, артериальной гипертонии и т.д.);
• сократить затраты на лечение (косвенно за счет сокращения числа госпитализаций).
Литература
1. Manton KG, et al. Chronic disability trends in elderly United States populations 1982–1994. Proceedings of the National Academy of Sciences, 1997, 94:2593–2598.
2. Caporali P. et al. Semin Arthritis Rheum 2005; 35 (Suppl. 1): 31–37
3. Wang P. et al., Hypertension, 2005, 46, 273
4. Bassleer CT, CombanJPA, Bougaret S et al. Effect of chondroitin sulfate and IL–1 beta on human articular chondrocytes cultivated in clusters. Osteoarthritis & Cartilage 1998; 6:196–204.
5. Leeb BF, Schweitzer H, Montag K, Smolen JS. A meta–analysis of chondroitinsulfate in the treatment of osteoarthritis. Osteoarthritis Cartilage, 1999,7, Suppl A, abstr 130.
6. Malaise M, Marcolongo R, Uebelhart D, et al. Efficacy and tolerability of 800 mg oral chondroitin 4,6–sulfate in the treatment of knee osteoarthritis: a randomized, double–blind multicentre study versus placebo. In: Mautone G, Tajana E, Rovati S, Vacher D, editors. New a ppoaches in OA. Zurich:Litera Rheumatologica 24, EULAR;1999:15–20.
7. Yaron I, Shirasi R, Judovich R, Yaron M. Chondroitin sulfate inhibits prostaglandin E2 production in synovial cell cultures and reverses IL–1 inhibition of cartilage synthesis. Ann Rheum Dis 2000, 59 (Suppl 1):265.
8. Uebelhart D, Eugene JM, Thonar E, et al. Prospective effect of exogenous chondroitin 4,6–sulfate in the acute degradation of articular cartilage in the rabbit. Osteoarthritis & Cartilage 1998; 6:6–13.
9. Uebelhart D, Knussel O, Theiler R. Efficacy and tolerability of oral chondroitin–sulfate in painful knee osteoarthritis: a double–blind, placebo–controlled, multicentre 6–month trial. Osteoarthritis Cartilage, 1999;7, Suppl A, abstr 144.
10. Pavelka K, Manopulo R, Busci L. Double–blind, dose effect study of oral chondroitin 4&6 sulfate 1200mg, 800 mg, 200 mg and placebo in the treatment of knee osteoarthritis. In: Mautone G, Tajana E, Rovati S, Vacher D, editors. New a ppoaches in OA. Zurich:Litera Rheumatologica 24, EULAR;1999:15–20.
11. Rovati LC. Clinical development of glucosamine sulfate as selective drug in osteoarthritis. Rheumatology Europe 1997;26:70.
12 Rovati LC. Clinical efficacy of glucosamine sulfate in osteoarthritis of the spine. Rev Esp Reumatol 1993;20:325.
13. Register J–Y, Rovati L, Deroisy R et al. Glucosamine sulfate slows–down osteoarthritis progression in postmenopausal women : pooled analysis of two large, independent, randomized, placebo–controlled, double–blind, prospective 3–year trials. Ann Rheum Dis 2002, 61 (Suppl 1):THU0196.
14. Lippielo L, Grande D. In vitro chondroprotection of glucosamine and chondroitin sulfate in a rabbit model of a OA and demonstration of metabolic synergy on chondrocyte in vitro. Ann Rheum Dis 2000, 59 (Suppl 1):266.
16. Daniel O. Clegg, M.D., Domenic J. Reda, Ph.D et al. Glucosamine, Chondroitin Sulfate, and the Two in Combination for Painful Knee Osteoarthritis. N Engl J Med Volume 354;8:795–808
17. Алексеева Л.А., Чичасова Н.В., Беневоленская Л.И., Насонов Е.Л., Мендель О.И. Комбинированный препарат АРТРА при лечении остеоартроза//Терапевтический Архив №11, 2005.
18. Алексеева Л.А., Чичасова Н.В., Мендель О.И. Результаты применения препарата Артра при гонартрозе// Научно–Практическая ревматология №5, 2005.
19. Алексеева Л.А., Чичасова Н.В., Мендель О.И. Рациональный выбор базисной терапии при остеоартрозе. Результаты открытого рандомизированного многоцентрового исследования препарата АРТРА в России//РМЖ №24,2005.
20. Верткин А.Л., Наумов А.В. Деформирующий остеоартроз: стратегия ведения пациентов при соматической патологии//РМЖ, том 15, №14, 2007.
21. Верткин А.Л., Наумов А.В. и др. Остеопороз и дегенеративные заболевания позвоночника в общетерапевтической практике//РМЖ №25, 2006.
22. Наумов А.В., Верткин А.Л., Мендель О.И. Как повысить безопасность и эффективность «антиартрозной» терапии у пациентов с соматической патологией. // РМЖ, №26, 2007.
Источник
