Формирование костного блока позвоночника
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Бердюгин К.А.
1
Штадлер Д.И.
2
Гусев Д.А.
2
1 ФГБУ «Уральский научно-исследовательский институт травматологии и ортопедии им. В.Д. Чаклина» Минздрава России
2 МБУ «Центральная городская клиническая больница № 23»
Проведен обзор основных современных методик формирования индуцированного костного блока приоперациях на позвоночнике. Были рассмотрены следующие материалы: керамика на основе фосфатов и гидроксиапатита, полиметилметакрилата, полиэфир-эфиркетона и на основе тантала в сравнении с ауто- и аллокостью. Выявлены основные перспективные направления в развитии материалов для спондилодеза. Рассмотрены преимущества и недостатки отдельных материалов с точки зрения остеокондуктивности, остеоиндуктивности и способности стимулировать остеогенез, а также безопасности для внедрения. В ходе обзора было выявлено, что на данном этапе развития нет материалов, способных полностью соответствовать аутотрансплантату по своим свойствам. Перспективными материалами являются керамики на основе фосфатов и использование полиэфир-эфиркетонов в комбинации с другими материалами. Использование данных материалов требует клинической и статистической оценки результатов хирургического лечения.
индуцированный костный блок
трансплантат
передняя фиксация
1. Bae H.W., Zhao L., Kanim L.E.A., Wong P., Dela marter R.B., Dawson E.G. (2006) Intervariability and intravariability of bone morphogenetic proteins in commercially available demineralized bone matrix products // Spine. – 2006. – № 31. – P. 1299–1306.
2. Barlocher C.B., Barth A., Krauss J.K., Binggeli R., Seiler R.W. Comparative evaluation of microdiscectomy only, autograft fusion, polymethylmethacrylate interposition, and threaded titanium cage fusion for treatment of single-level cervical disc disease: a prospective randomized study in 125 patients // Neurosurg Focus. – 2002. – № 12.
3. Baskin D.S., Traynelis V. Failure of porous tantalum cervical interbody fusion devices: two-year results from a prospective, randomized, multi-center, clinical study // Annual Meeting, Cervical Spine Research Society, Boston, USA. – 2004.
4. Beaman F.D., Bancroft L.W., Peterson J.J., Kransdorf M.J. Bone graft materials and synthetic substitutes // RadiolClin North Am. – 2006. – № 44. – P.451–461.
5. Bishop R.C., Moore K.A., Hadley M.N. Anterior cervical interbody fusion using autogenetic and allogeneic bone graft substrate: a prospective comparative analysis // J Neurosurg. – 1996. – № 85. – P. 206–210.
6. Boyan B.D., McMillan J., Lohmann C.H., Ranly D.M., Schwartz Z. Bone graft substitutes: basic information for successful clinical use with special focus on synthetic graft substitutes. In:Laurencin CT (ed) one graft substitutes // ASTM International, West Conshohocken. – 2003. – P. 231–259.
7. Chau M.T. Bone graft substitutes in anterior cervical discectomy and fusion // Eur Spine J. – 2009. – № 18. – P. 449–464.
8. Chou Y.C., Chen D.C., Hsieh W.A., Chen W.F., Yen P.S., Harnod T., Chiou T.L., Chang Y.L., Su C.F., Lin S.Z., Chen S.Y. Efficacy of anterior cervical fusion: comparison of titanium cages, polyetheretherketone (PEEK) cages and autogenous bone grafts // J ClinNeurosci. – 2008. – № 15. – P. 1240–1245.
9. Ferna´ndez-Fairen M., Sala P., Dufoo M. Jr, Ballester J., Murcia A., Merzthal L. Anterior cervical fusion with tantalum implant: a prospective randomized controlled study // Spine. – 2008. – № 33. – P. 465–472.
10. Floyd T., Ohnmeiss D. A meta-analysis of autograft versus allograft // Eur Spine J. – 2000. – № 9. – P. 398–403.
11. Helm G. Bone graft substitutes for use in spinal fusions // ClinNeurosurg. – 2005. – № 52. – P. 250–255.
12. Liao J.C., Niu C.C., Chen W.J., Chen L.H. Polyetheretherketone (PEEK) cage filled with cancellous allograft in anterior cervical discectomy and fusion // IntOrthop. – 2008. – № 32. – P. 643–648.
13. Moore W.R., Graves S.E., Bain G.I. Synthetic bone graft substitutes // ANZ J Surg. – 2001. – № 71. – P. 354–361.
14. Shors E.C. The development of corraline porous ceramic bone. In: Laurencin CT (ed) Bone graft substitutes // ASTM International, West Conshohocken. – 2003. – P. 271–288.
15. Spivak J.M., Hasharoni A. Use of hydroxyapatite in spine surgery // Eur Spine J. – 2001. – № 10. – P. 198–204.
16. Suetsuna F., Yokoyama T., Kenuka E., Harata S. Anterior cervical fusion using porous hydroxyapatite ceramics for cervical disc herniation. a two-year follow-up //Spine J Off J N Am Spine Soc. – 2001. – № 1. – P. 348–357.
17. Wittenberg R.H., Moeller J., Shea M., White A.A., Hayes W.C. Compressive strength of autologous and allogenous bone grafts for thoracolumbar and cervical spine fusion // Spine. – 1990. – № 15. – P. 1073–1078.
Формирование индуцированного костного блока является необходимым элементом хирургического лечения повреждений и заболеваний позвоночника, связанных с нарушением стабильности позвоночных двигательных сегментов. Применение костного аутотрансплантата на протяжении последних 40–50 лет является золотым стандартом для формирования костного блока [1]. Однако применение аутотрансплантата имеет свои недостатки и ограничения, связанные с нанесением дополнительной операционной травмы, косметическим дефектом в зоне забора трансплантата, возможными воспалительными осложнениями [2]. За последнее десятилетие разработано достаточное число материалов, являющихся альтернативой аутотрансплантату и постоянно ведется работа ученых в данном направлении. Все последние открытия в медицине, биологии, химии, металловедении ложатся в основу создания новых трансплантатов, становящихся альтернативой аутокости.
Целью данной работы является обзор современных методик формирования индуцированного костного блока применимо к хирургии позвоночника.
Результаты исследования и их обсуждение
Аутотрансплантат губчатой кости содержит гидроксиапатит и коллаген, которые определяют его остеокондуктивные свойства, в то время как стромальные клетки имеют остеогенный потенциал. Губчатая кость и окружающая гематома содержат костные морфогенетические белки (BMP) и преобразующий b-фактор роста (TGF-β), которые участвуют в процессах регенерации. Компактная кость обладает слабо выраженным остеокондуктивным эффектом, но способна выдерживать механическую нагрузку. Аутотрансплантат имеет три характеристики трансплантата для идеального формирования индуцированного костного блока, а именно: способность стимулировать остеогенез, способность стимулировать дифференциацию мезенхимальных клеток-предшественников и остеобластов (остеоиндуктивность) и способность материала играть роль пассивного матрикса для роста новой кости (остеокондуктивность) [2, 13]. Аутотрансплантат имеет ряд преимуществ по отношению к другим способам замещения костной ткани: относительно редко встречаются случаи миграции и проблемы с биосовместимостью, отсутствие риска передачи болезней [5]. По этим причинам использование аутотрансплантата остается золотым стандартом при проведении спондилодеза.
Аллотрансплантат кости обычно используется как альтернатива аутотрансплантату. Основное преимущество аллотрансплантатов – отсутствие осложнений, связанных с забором костной ткани, и снижение времени оперативного вмешательства [10]. Недостатками является риск передачи от донора к реципиенту различных заболеваний бактериальной или вирусной этиологии [7], а также необходимость проведения серологического скрининга и стерилизации трансплантатов перед использованием. Костные аллотрансплантаты отличаются медленной остеоинтеграцией, возможностью развития реакции гистосовместимости, частым развитием хронического гранулематозного воспаления, высокой стоимостью. С целью минимизации рисков аллотрансплантаты подвергают интенсивной обработке, что значительно уменьшает остеоиндуктивные свойства и механическую прочность почти на 50 %, хотя риск инфицирования реципиента всё же полностью не устраняется. Свойства аллотрансплантатов могут варьировать в широких пределах, и связано это в первую очередь с методами забора и подготовки трансплантата. Различные виды обработки аллотрансплантата могут вариативно влиять на его структурные и биологические характеристики. Включение аллотрансплантата происходит путем процесса, аналогичного тому, который наблюдается с аутотрансплантатом, но более медленно и менее полно. Остеокондуктивные матрицы не содержат остеогенных клеток или остеоиндуктивных факторов, поэтому часто используются совместно с ВМР. Так как материалы являются хрупкими, то необходима их защита от чрезмерных биомеханических сил до окончательного формирования костного блока. Также, в отличие от синтетических протезов, аллотрансплантаты трудно стандартизировать в виду неоднородности доноров, а содержание костных банков является дорогостоящей процедурой. Гомоаллотрансплантат выпускается в двух видах: минерализованный и деминерализованный. Минерализованный аллотрансплантат считается не остеогенным, слабо остеоиндуктивным, высоко остеокондуктивным и доступен в свежем, замороженном или лиофилизированном виде. Деминерализованный аллотрансплантат – единственный аллотрансплантат с выраженным остеоиндуктивным эффектом, выраженность эффекта зависит от способа забора и обработки. Главной проблемой применения трансплантата являются неразработанные критерии качества продукта и недостаточная информация о продукте. В одном из немногих доступных исследований приводится сравнение замороженного минерализованного аллотрансплантата и деминерализованного аллотрансплантата с аутотрансплантатом, при этом полученные результаты были сопоставимы в группах, но не достигли статистической значимости [1, 7].
Керамика на основе фосфатов. Керамика представляет собой кристаллическую структуру, состоящую из неорганических неметаллических минеральных солей, полученную при высоких температурах. Изменения методики в процессе обработки керамики изменяют окончательную структуру и химический состав, а следовательно, и ее физиологические свойства. Керамика является привлекательной в качестве заменителя трансплантата, так как при её использовании исключаются осложнения со стороны донорского участка, проявляется биосовместимость, отсутствует риск передачи инфекции, и её запасы практически безграничны. C 1890 г. кальций-фосфатные материалы используются в медицине. Albee в 1920 г. впервые доказал, что трикальций-фосфат стимулирует образование кости. Кальций-фосфатные материалы, являясь химическими аналогами компонентов костной ткани, стимулируют биологические реакции, схожие с процессом ремоделирования костей. Резорбция данных материалов не повышает уровня кальция или фосфатов в моче и сыворотке [15]. Трикальцийфосфат (ТКФ) и гидроксиапатиты (ГА) являются наиболее изученными материалами для использования. Ввиду их химико-физических сходств с фазой минерализации кости [11] они обеспечивают отличный остеокондуктивный каркас для регенерации кости. ТКФ с молярным соотношением Ca:P 1,5 резорбирует слишком быстро, ГА с соотношением Ca:P 1,67 резорбирует слишком медленно, поэтому для защиты новой кости от механических воздействий оно требует модификации [6]. Двухфазные фосфаты кальция (ДФК), в которых соединяется 40 % ТКФ с 60 % ГА, могут обеспечить больший физиологический баланс между механической поддержкой и резорбцией. Yamada и др. провели гистологическое исследование β-ТКФ, ГА для того, чтобы определить, какой из них более подвержен остеокластной активности и больше подходит для ремоделирования кости. Через 2 дня культивирования клеток была замечена резорбция чистого β-ТКФ и ДФК с коэффициентом ГА/β-ТКФ 25/75, но отсутствовала резорбция ДКФ 75/25 или чистого ГА. Примечательно, что ДФК 25/75 резорбировался интенсивней, чем чистый β-ТКФ, возможно, из-за ингибирования кальцием остеокластов, и формировались полости резорбции, схожие с полостями нормальной кости. Данный факт даёт основание предположить, что ДФК является более естественным имплантатом, чем отдельно взятые β-ТКФ или ГА. Биомеханическим требований отвечает ДКФ 60/40, он и используется клинически [16].
Коралловый гидроксиапатит. В процессе гидротермальной трансформации кораллового скелета (карбонат кальция) с участием фосфатного составляющего вырабатывается гидроксиапатит кальция (известный как коралловый ГА), и полностью удаляется иммуногенный протеин. Получение кораллового ГА являлось непрогнозируемым научным достижением, основывавшемся на сходстве строения некоторых видов кораллов со строением кости. Два вида кораллов с подходящей пористостью были выбраны для производства, они имеются в продаже под названием ProOsteon 200 (50 % пористость) или 500 (65 % пористость), в соответствии с размером их пор в микронах. Эти два продукта имеют сходство с трубчатой или губчатой костью соответственно [14]. Wittenberg и др. обнаружили, что ProOsteon 200 такой же прочный, как и компактно-губчатый аутотрансплантат из гребня подвздошной кости [17].
Полиэфир-эфиркетон (ПЭЭК). Является рентгеннегативным полукристаллическим термопластиком, сочетает в себе прочность жесткость, твердость и биосовместимость, также износостойкость и возможность повторного использования после стерилизации. Является безопасным, биосовместимым и стабильным полимером, имеющимся в различных формах, которые предлагает практически неограниченные дизайнерские решения. Одной из основных проблем ортопедической хирургии является несоответствие между жесткостью кости и металлическими или керамическими имплантатами, в то время как жесткость ПЭЭК может быть адаптирована. Его прочность может быть дополнительно увеличена путем добавления частиц или волокон углерода. Вариация жесткости при использовании коротких углеродных волокон в пределах 4–18 ГПа, прочность зависит от полимерной основы и варьирует в пределах 100–230 МПа. Свойства полимера не меняются при высоких температурах, выдерживают длительную экспозицию при +230 и короткую экспозицию при + 300. Полимер также показывает высокую химическую стойкость, материал не ухудшал свои свойства после воздействия смоделированных биологических сред в течение 30 дней [8, 12].
Полиметилметакрилат (ПММА). В ходе двух проспективных рандомизированных исследований было выявлено, что ПММА не имеет определённых клинических преимуществ перед аутотрансплантатом. Рентгенологически Barlocher и др. обнаружили, что ПММА не индуцировал сращения у всех 24 пациентов за 12 месяцев [2]. Van den Bent и др. обнаружили, что ПММА способствовал меньшему количеству костных блоков, чем дискотомия с использованием аутокости, также возникали случаи смещения трансплантата в смежный позвонок, и с ПММА было связано возникновение фиброзного уплотнения окружающей кости [7].
Танталовые имплантаты. Имплантат пористой структуры, полученный из чистого тантала, с 1997 года активно применяется в травматологии и ортопедии, нейрохирургии в качестве имплантата, обладающего остеокондуктивными свойствами. Отличительные особенности данного имплантата ‒повышенная пористость и более свободное сообщение между ячейками. Конструкции из тантала обладают достаточной жесткостью и трением, что позволяет применять имплантаты без дополнительной фиксации. Гистологически доказано быстрое врастание костной ткани в пористый тантал [9], а также стимуляция им остеобластов [3].
Заключение
На современном этапе развития костнозамещающих технологий существует несколько перспективных вариантов материалов, способных заменить аутотрансплантат в будущем, однако на данный момент нет возможности полного отказа от использования аутотрансплантатов. Перспективными материалами, требующими дальнейших исследований и оценки клинического применения, являются керамики на основе фосфатов, полиэфир-эфиркетон и имплантаты на основе пористого тантала.
Рецензенты:
Щеколова Н.Б., д.м.н., профессор кафедры травматологии, ортопедии и ВПХ, ГБОУ ВПО ПГМА им. Е.А. Вагнера Минздрава РФ, г. Пермь;
Борзунов И.В., д.м.н., ученый секретарь Ученого совета, ГБОУ ВПО «Уральская государственная медицинская академия Минздрава РФ», г. Екатеринбург.
Работа поступила в редакцию 18.03.2014.
Библиографическая ссылка
Бердюгин К.А., Штадлер Д.И., Гусев Д.А. СОВРЕМЕННЫЕ МАТЕРИАЛЫ ДЛЯ ФОРМИРОВАНИЯ ИНДУЦИРОВАННОГО КОСТНОГО БЛОКА ПРИ ОПЕРАЦИЯХ НА ПОЗВОНОЧНИКЕ // Фундаментальные исследования. – 2014. – № 4-2. – С. 415-418;
URL: https://fundamental-research.ru/ru/article/view?id=33857 (дата обращения: 27.11.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
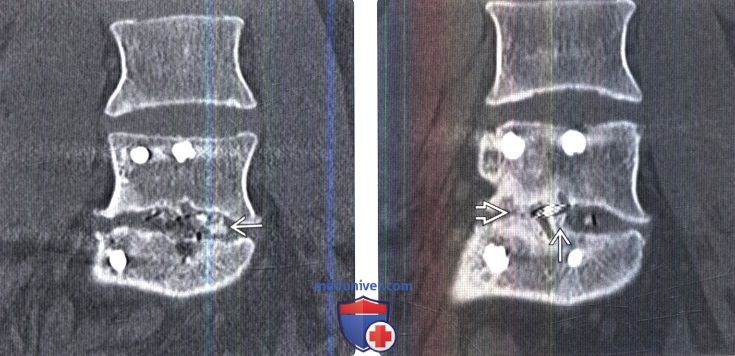
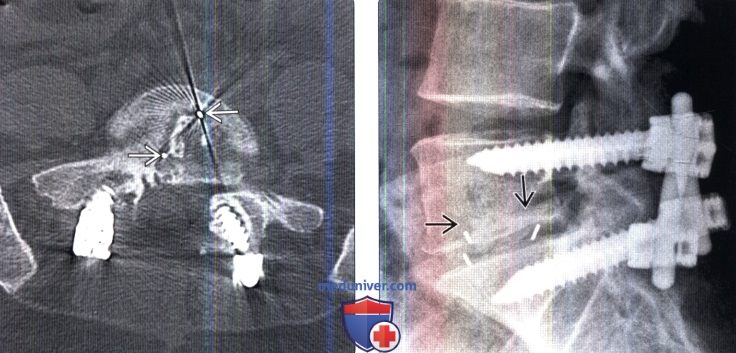
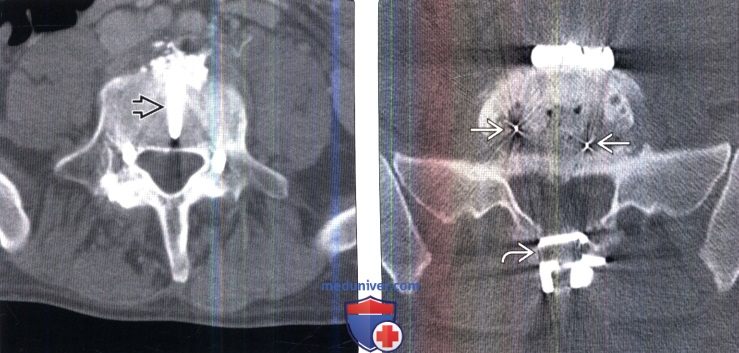
Лучевая оценка межтеловых спейсеров позвоночникаа) Терминология: 1. Синонимы: 2. Определения: б) Визуализация: 1. Общие характеристики: 2. Рентгенологические данные межтелового спейсера позвоночника: 3. КТ межтелового спейсера позвоночника: 4. МРТ межтелового спейсера позвоночника: 5. Рекомендации по визуализации: 6. Радиоизотопные исследования:
в) Дифференциальная диагностика межтелового спейсера позвоночника: 1. Кейджи: 2. Искусственный поясничный межпозвонковый диск: 3. Искусственный шейный межпозвонковый диск:
г) Патология: 1. Общие характеристики: 2. Стадирование, степени и классификация межтелового спейсера позвоночника:
д) Клинические особенности: 1. Клиническая картина межтелового спейсера: 2. Течение заболевания и прогноз: 3. Лечение: е) Диагностическая памятка: 1. Следует учесть: 2. Советы по интерпретации изображений: 3. Нюансы протокола исследования: ж) Список использованной литературы: — Также рекомендуем «Рентгенограмма, КТ, МРТ межостистого стабилизирующего устройства позвоночника» Редактор: Искандер Милевски. Дата публикации: 18.9.2019 |
Источник