Постлучевые изменения в позвоночнике
В.С. Шевченко, НИИ онкологии АМН Украины, г. Киев
Международный неврологический журнал 4(20) 2008 / Практикующему неврологу /To Practicing Neurologist/
Лучевая терапия в различных ее модификациях является одним из ведущих методов лечения в онкологии. Несмотря на высокую эффективность и отсутствие альтернативы в некоторых случаях, актуальной остается проблема негативных ее последствий — фиброза, лучевых ожогов кожи и слизистых, угнетения костномозгового кроветворения и пр. Наиболее распространенными осложнениями лучевой терапии являются поражения нервной системы — плекситы, невриты различных локализаций [1, 2]. Ниже приводится описание клинического случая хронической постлучевой миелопатии под маской вторичной интоксикационной полиневропатии.
Больной В., 1964 года рождения, житель Одесской области, поступил в отделение опухолей головы и шеи НИИ онкологии АМН Украины в декабре 2006 года с диагнозом: рак корня языка T2N0M0, стадия ІІ, клиническая группа ІІ. Диагноз верифицирован цитологически — плоскоклеточная карцинома. Получал химиолучевую терапию, суммарная доза облучения составила 60 Гр по расщепленной методике в 2 этапа по 30 Гр с интервалом 4 недели, последний курс облучения — в марте 2007 г.
С сентября 2007 года больной отмечает появление жалоб на слабость в ногах, шаткость при ходьбе, недержание мочи и кала. По месту жительства осмотрен онкологом, невропатологом, урологом, проктологом, обследован (компьютерная томография органов грудной полости, рентгенография пояснично-крестцового отдела позвоночника, ультразвуковое исследование органов брюшной полости и малого таза, ирригография). В результате проведенного обследования данных о пролонгации основного заболевания не получено. Для дальнейшего обследования и лечения направлен повторно в НИИ онкологии АМН Украины с предварительным диагнозом: рак корня языка, Т2N0M0, стадия II, клиническая группа ІІ, состояние после химиолучевой терапии, вторичная интоксикационная полиневропатия.
При поступлении в ноябре 2007 года консультирован неврологом. Предъявляет жалобы на выраженную слабость в руках и ногах, боли в шейном отделе позвоночника, периодически возникающие судороги в ногах, шаткость при ходьбе с тенденцией к падению, недержание мочи и кала. Общее состояние больного на момент осмотра оценено как тяжелое, сознание ясное, контактен, адекватен, ориентирован во времени и пространстве. В неврологическом статусе: со стороны черепно-мозговых нервов очевидной патологии не выявлено. Глубокие рефлексы с рук и ног повышены симметрично, определяются патологические стопные знаки сгибательной и разгибательной групп с обеих сторон. Гипестезия с уровня Th5 по проводниковому типу. Глубокая чувствительность не нарушена. Мышечная сила в руках и ногах снижена до 3–3,5 балла. Мышечный тонус симметрично повышен по пирамидному типу. Верхнюю и нижнюю пробы Барре выполняет с выраженной дисметрией, мимопопаданием с обеих сторон. В позе Ромберга — шаткость с тенденцией к падению. Менингеальный симптомокомплекс не убедителен. Функция тазовых органов нарушена по центральному типу (недержание мочи и кала).
МРТ шейного отдела позвоночника с внутривенным усилением: с уровня С2 по Th1 определяется тотальное снижение плотности вещества спинного мозга без компрессии спинномозгового канала (рис. 1), что с учетом анамнеза расценено как постлучевая миелопатия. Костнодеструктивных изменений не обнаружено.
После проведенного дообследования установлен диагноз: хроническая постлучевая миелопатия шейного отдела.
Больному назначена комплексная терапия с применением противоотечных, антихолинэстеразных препаратов, дезагрегантов. Со слабо положительной динамикой пациент выписан под наблюдение онколога и невропатолога по месту жительства.
Описанный случай свидетельствует о необходимости проведения дифференциальной диагностики при клинических признаках поражения спинного мозга у онкологических больных.
Источник
Перейти в содержание Вестника
РНЦРР МЗ РФ N5.
Текущий
раздел: Лучевая терапия
Факторы риска постлучевых повреждений у
больных раком молочной железы.
Хмелевский Е.В., Добренький
М.Н., Сергоманова Н.Н., Снигирева Г.П.,
Пархоменко Р.А., Богомазова А.Н..ФГУ Российский Научный Центр Рентгенорадиологии
МЗ и СР РФ (г.Москва)
Адрес
документа для ссылки: https://vestnik.rncrr.ru/vestnik/v5/papers/hmel_v5.htm
Оглавление:
Резюме.
Введение.
Материал и методы.
Результаты.
1.
Ранние постлучевые
изменения.
2.
Поздние
постлучевые повреждения.
Список
литературы.
Резюме.
Проведен анализ реакций и
осложнений, сопровождавших различные варианты
лучевой терапии 1032 наблюдавшихся в 1977-2002гг больных раком молочной железы. Ста шестидесяти трем из них
проведено органсохраняющее лечение, 761-й — комплексное, включавшее один из
вариантов радикальной мастэктомии и 108 — самостоятельное химио-лучевое
лечение. Ранние постлучевые изменения оценивали на основании стандартной шкалы
токсичности ВОЗ (1998), а поздние — шкалы RTOG/EORTC.
Среди прогностических
факторов ранних постлучевых изменений наибольшее значение имели:
— уровень эквивалентной
очаговой дозы: частота реакций (главным образом — влажных эпидермитов) возрастала
в 3 раза, достигая 90% случаев в интервале доз 40-70 Гр;
— использование
неоадъювантной полихимиотерапии, увеличивавшей суммарную частоту ранних
реакций на 20%;
— левосторонняя
локализация рака молочной железы повышающая риск кардиальных изменений по сравнению с правосторонней,
особенно в сочетании с такими
факторами, как средний возраст больных (45 — 55 лет), в сочетании
с сопутствующей сердечно-сосудистой патологией и при СОД на грудную стенку более 40 Гр
— в 1,3-1,5 раза.
Поздние изменения здоровых тканей, как правило
— слабо или умеренно выраженные (1-2 степени), обнаруживались у каждой
четвертой больной. При этом мягкотканые
фиброзы, пневмосклерозы и кардиальные осложнения составили в сумме более
90% выявленных повреждений. Основным прогностическим фактором являлась очаговая доза, причем критической точкой
для развития постлучевых фиброзов
оказалась доза на всю молочную железу 66 Гр, а
вероятность пневмосклероза возрастала
более чем в 5 раз, достигая 70%-го уровня, в интервале доз 65-80 Гр на переднюю грудную стенку. Почти в 3
раза увеличивалась вероятность появления пневмосклероза при сочетании
лучевой терапии и цикловой полихимиотерапии.
Среди факторов, влияющих
на частоту поздних кардиальных изменений, помимо дозы достоверное значение имела левосторонняя
локализация рака молочной железы,
повышавшая риск кардиальных повреждений, в целом, в 1.4 раза, в том числе, в средней возрастной группе (45 -55 лет)- в 2,7 раза, а при
использовании ПХТ
— в 1,5 раза, а также, независимо от
локализации, сопутствующая сердечно-сосудистая патология – в 2 раза.
Перейти в
оглавление статьи >>>
Введение.
На фоне возрастающего
значения лекарственного лечения не снижается
и роль лучевой терапии при раке молочной железы. Рутинным стало облучение оперированной железы после органсохраняющих операций. Эффективность постмастэктомической
лучевой терапии при ПВ-ШВ стадиях подтверждается
не только в отдельных исследованиях, но и результатами метаанализов (4). Нет альтернативы радикальному облучению при неоперабельном
местнораспространенном опухолевом процессе.
В то же время, близость
жизненно важных органов, наряду с необходимостью
подведения высоких очаговых доз к значительным объемам тканей
как при органсохраняющем лечении начальных форм
заболевания, так и в случае местнораспространенных опухолей делают проблему постлучевых
повреждений здоровых тканей при лечении рака молочной железы чрезвычайно
актуальной. Так частота наиболее опасных из
них — пульмонитов и кардиальных повреждений
достигает 10-15% случаев.
Однако страшен не сам факт
возникновения осложнений, а их не всегда осознаваемые
последствия. По подсчетам P.Lind и соавт., (3)
возникновение пульмонита аналогично потере частилегкого, что, в
свою очередь, равносильно потере 15 лет жизни пациентки. Постлучевые же
изменения сердечно-сосудистой системы
являются причиной дополнительной кардиальной смертности 5% излеченных от рака женщин. Именно поэтому
определение факторов риска ранних и поздних простлучевых
осложнений приобретает важнейшее значение.
Перейти в
оглавление статьи >>>
Материал и методы.
Проведен анализ реакций и
осложнений, сопровождавших различные
варианты лучевой терапии 1032 наблюдавшихся нами в 1977-2002гг больных раком молочной железы. Ста
шестидесяти трем из них проведено органсохраняющее
лечение, 761-й — комплексное, включавшее один из вариантов радикальной мастэктомии и 108 —
самостоятельное химио-лучевое
лечение. Методики лучевой терапии подробно описаны нами ранее (1,2)
Ранние постлучевые изменения оценивали на основании
стандартной шкалы токсичности ВОЗ
(1998), а поздние — шкалы RTOG/EORTC. При оценке повреждений
сердечно-сосудистой системы отмечались
изменения как обнаруженные впервые, так и имевшие
характер обострения хронической патологии, а так же бессимптомные реакции, регистрируемые только с помощью ЭКГ.
Статистическую обработку
результатов проводили с помощью программ «Таблица»
(М.М. Тейблюм) и «Microsoft Excel»;
для оценки достоверности отличий использовали t-критерий Стьюдента.
Перейти в
оглавление статьи >>>
Результаты.
1.
Ранние
постлучевые изменения.
Общая частота ранних
побочных изменений составила 36,3%
случаев, причем 80% из них — это влажные эпидермиты и ранние послеоперационные осложнения. Среди
прогностических факторов наибольшее
значение имели:
—
выбор
источника ионизирующего излучения: применение тормозного и электронного пучков медицинского ускорителя
достоверно снизило вероятность появления
реакций, в целом, в сравнении с дистанционной гамма-терапией
почти в 2 раза;
—
уровень
эквивалентной очаговой дозы: частота реакций возрастала в 3 раза, достигая 90% случаев в интервале доз 40-70 Гр; использование расщепления при высокодозном (>60Гр) облучении нивелировало эти
отличия;
— наличие сопутствующей,
главным образом — сердечно-сосудистой патологии,
в 1,5 раза повышавшей вероятность развития ранних побочных изменений;
— использование неоадъювантной полихимиотерапии,
увеличивавшей суммарную частоту ранних
реакций (почти исключительно — за счет общих и гематотоксических) на 20%.
Обнаружены некоторые неизвестные ранее
закономерности развития ранних побочных изменений здоровых тканей. Так,
выявлена обратная зависимость между вероятностью
появления реакций и величиной противоопухолевого эффекта: при максимальном эффекте отмечен минимальный уровень
реакций и наоборот. В частности,
10-летняя безрецидивная выживаемость, оказалась в 2
раза выше у больных не имевших
выраженных ранних изменений нормальных тканей: 45,4% против 21,0% — в
случае возникновения последних (р=0.015). Весьма
возможно, что общая частота ранних реакций
косвенно отражает состояние противоопухолевой резистентности
организма.
Вероятность развития
влажного эпидермита коррелировала
с возрастом, достоверно повышаясь у
пожилых пациенток (старше 65 лет). При этом время появления кожной реакции находилось в обратной связи с ее
интенсивностью: позднее появление
сопровождалось более глубоким уровнем конечного повреждения. Этот феномен обнаруживался уже во всех
возрастных группах. Принимая во внимание
отмеченную выше взаимозависимость реакции и терапевтического эффекта, можно рассматривать
относительно более позднее появление
изменений кожи в процессе лучевой терапии, как своего рода неблагоприятный прогностический признак.
Наиболее отчетливая зависимость «доза —
эффект» для влажного эпидермита
наблюдалась при послеоперационном широкопольном
облучении грудной стенки быстрыми
электронами. В интервале доз 46-60 Гр частота реакции возрастала почти в
3 раза: с 25% до 72%. Положительное влияние расщепления, стабилизировавшего
этот показатель и при послеоперационном, и при радикальном облучении на уровне 25-30%, переставало сказываться лишь после
достижения дозы 80 Гр.
Среди
прогностических факторов, влияющих
на возникновение ранних сердечно-сосудистых изменений,
достоверное значение имели:
1) левосторонняя локализация
рака молочной железы,
самостоятельно
повышающая риск кардиальных изменений по сравнению с
правосторонней в 1,2
раза, а в сочетании с:
—
сопутствующей
сердечно-сосудистой патологией — в 1,3 раза;
—
в средней
возрастной группе (45 — 55 лет)- в 1,4 раза;
— при
СОД на грудную стенку более 40 Гр — в 1,5 раза;
2) сочетание
лучевой терапии с полихимиотерапией — в 1,5 раза
повышавшее
частоту сердечно-сосудистой патологии
независимо от присутствия иных факторов.
Вероятность регистрации
ранних изменений со стороны легких коррелировала с методом облучения, снижаясь до нуля при использовании высокоэнергетических электронов. Впрочем, и после
дистанционной гамма-терапии острые пульмониты, возникали весьма редко — менее, чем в 2% случаев.
Перейти в
оглавление статьи >>>
2.
Поздние
постлучевые повреждения.
Поздние
изменения здоровых тканей, как
правило — слабо или умеренно выраженные (1-2 степени), обнаруживаются у каждой четвертой больной. При этом мягкотканные фиброзы, пневмосклерозы и кардиальные осложнения составляют в сумме более 90% выявленных повреждений.

Рис.1. Частота пневмосклероза после
комбинированного лечения с послеоперационной (ПоЛТ — 50Гр за 25 фракций электронами 10-22Мэв) или
предоперационной (ПрЛТ — 20Гр или 25Гр за 5
ежедневных тормозным излучением 25Мэв
или ДГТ) лучевой терапией.

Рис. 2. Зависимость
частоты постлучевого пневмосклероза от суммарной очаговой дозы при самостоятельной лучевой терапии
неоперабельного рака молочной железы.
Наконец, почти в 3 раза
возрастала вероятность появления пневмосклероза при
сочетании лучевой терапии и цикловой полихимиотерапии.
Среди факторов, влияющих
на частоту обнаружения поздних изменений на ЭКГ, достоверное
значение имели:
1) левосторонняя
локализация рака молочной
железы, повышавшая риск
кардиальных повреждений, в целом, в 1.4 раза, и, в том числе:
—
в
средней возрастной группе (45 -55 лет)- в 2,7 раза;
—
при использовании ПХТ — в 1,5
раза.
2) во всех случаях обнаружения
сопутствующей сердечно-сосудистой патологии
— в 2 раза;
 3).при проведении лучевой терапии с суммарной
3).при проведении лучевой терапии с суммарной
очаговой дозой на грудную стенку более 40Гр – от 1,5 до 4 раз (рис3).
Рис.3.Вероятность
развития поздних изменений сердечно-сосудистой системы в зависимости от дозы и стороны поражения.
Крайне важно, что
обострение кардиальной патологии во время или после окончания противоопухолевой терапии в 6 раз (с 2% до 13%
случаев) увеличивало риск гибели от сопутствующих сердечно-сосудистых
заболеваний (рис.4).
 |
Рис.4.Вероятность смерти от
сердечно-сосудистой патологии после радикального лечения рака молочной железы (медиана
наблюдения — 80,6 мес.) в зависимости от исходного кардиального статуса
пациентки и частоты кардиальных реакций
и/или осложнений.
Данный пример
демонстрирует реальное сокращение терапевтического интервала,
достигающее величины 10% при уровне дозы 74 Гр у
пациенток с левосторонней локализацией
опухолевого процесса, имеющих в анамнезе кардиальную патологию.
Наконец, возможную
корреляцию конститутивных особенностей пациентов с
выраженностью постлучевых осложнений пытались обнаружить с по’мощью цитогенетического
метода. Среднегрупповая частота дицентрических
и кольцевых хромосом, индуцированных в лимфоцитах invitroгамма-излучением в дозе 2 Гр, составила, в частности, при фиброзе 2й степени
27.9 ± 1.0 на 100 клеток и достоверно
превысила этот показатель в группе больных с фиброзом 1й степени: 21.4 ± 1.0 на 100 клеток (р
< 0.01, точный критерий Фишера). В то же время, большой разброс
значений цитогенетических показателей как внутри групп, так и между ними значительно осложняет использование этого
метода, как способа прогноза
индивидуальной радиочувствительности пациентов. Таким
образом, наши данные свидетельствуют
о том, что повышенная радиочувствительность хромосом действительно может оказывать влияние на
формирование поздних лучевых повреждений, но в то же время не является
ключевым фактором риска.
Перейти в
оглавление статьи >>>
Список литературы.
1.
Харченко
В.П., Паныпин Г.А., Хмелевский Е.В. Лучевая терапия
при раке молочной
железы// В кн.:
Лучевая
диагностика заболеваний
молочной железы, лечение,
реабилитация. Вып.4.- М., СТРОМ.- 2001.-
С.57-98
2.
Хмелевский Е.В.
Современная лучевая терапия в
лечении
местнораспространенного и рецидивирующего рака
молочной железы//Дисс.докт.мед.наук.-М, 1997
3.
bind P., Rosfors S., Wennberg В., Glas U., Bevegard S., Fornander T.
Pulmonary function following adjuvant chemotherapy and radiotherapy for
breast cancer
and the issue of three-dimentional treatment
planning// Radiother
Oncol.-1998.-V.49.-P.245-254
4.
Van de Steen J., Soete
G., Storme G. Adjuvant radiotherapy for breast cancer
significantly improves overall survival: the missing link//// Radiother Oncol.-
2000.-V.55.-P.263-272.
Перейти в
оглавление статьи >>>
© Вестник РНЦРР Минздрава России
©
Российский научный центр рентгенорадиологии Минздрава России
Источник
Лучевая диагностика постлучевых изменений костного мозга
а) Определения:
• Трансформация на фоне лучевой терапии красного костного мозга в жировой
б) Визуализация:
1. Общие характеристики:
• Наиболее значимый диагностический признак:
о Интенсивность сигнала (ИС) костного мозга в пределах зоны облучения в Т1-режиме соответствует ИС подкожной клетчатки
• Локализация:
о Соответствует области облучения
• Размеры:
о Соответствуют размерам области облучения
• Морфология:
о Однородная гиперинтенсивность сигнала костного мозга:
— Неоднородный характер сигнала дает основание заподозрить рецидив поражения костного мозга
о Четкие границы между измененным и неизмененным костным мозгом (границы области облучения)
2. Рентгенологические данные постлучевых изменений костного мозга:
• Рентгенография:
о ± остеопения, компрессионные переломы
3. КТ постлучевых изменений костного мозга:
• Костная КТ:
о ± компрессионные переломы
о Неинформативна в отношении диагностики жировой перестройки костного мозга
4. МРТ постлучевых изменений костного мозга:
• Т1-ВИ:
о Очень высокая интенсивность сигнала костного мозга (соответствует жировой ткани)
• Т2-ВИ:
о Промежуточная ИС, соответствует жировой ткани
• PD/промежуточный режимы:
о Промежуточная ИС, соответствует жировой ткани
• STIR:
о Высокая интенсивность сигнала в острую фазу (отек)
о Низкая интенсивность сигнала в последующем (жировая перестройка)
• Т1-ВИ с КУ:
о Контрастное усиление сигнала в острую фазу:
— Возможно связано с застойными явлениями
о В последующем контрастное усиление исчезает:
— Снижение кровоснабжения, фиброз
• Первые три недели:
о Отсутствие изменений или ранняя гиперинтенсивность Т1-сигнала костного мозга:
— Гиперинтенсивность сигнала позволяет предположить наличие кровоизлияний ± жировую перестройку
о Гиперинтенсивность в STIR:
— Отек и некроз костного мозга
— Изменения наиболее выражены в течение первых 9 дней после облучения, в последующем ИС постепенно снижается
• 3-6 недель:
о Неоднородный пятнистый характер сигнала в Т1
о Усиление сигнала за счет жировой перестройки в центральных отделах тел позвонков вокруг базивертебральных вен
• После шести недель:
о Диффузная и гомогенная гиперинтенсивность сигнала в Т1
о Полосы промежуточной ИС по периферии:
— Вокруг центрального гиперинтенсивного костного мозга
— Могут быть отражением регенерации гемопоэтического костного мозга
о Характерные изменения, захватывающие >90% костного мозга в пределах области облучения
5. Радиоизотопные исследования:
• Костная сцинтиграфия:
о Четко ограниченное очаговое или диффузное снижение захвата изотопа вследствие уменьшения кровоснабжения облученных участков костного мозга
• ПЭТ:
о Снижение метаболической активности костного мозга
• Сцинтиграфия с серным коллоидом, меченым 99mТс:
о Четко ограниченная «холодная» зона, соответствующая границам области облучения
6. Другие методы исследования:
• Двухэнергетическая рентгеновская абсорбциометрия:
о Возможно уменьшение костной массы
7. Рекомендации по визуализации:
• Наиболее оптимальный метод диагностики:
о Методом выбора при исследовании костного мозга является МРТ
• Протокол исследования:
о Т1-ВИ — наиболее чувствительный в отношении диагностики жировой перестройки костного мозга режим
о STIR или FSET1 с насыщением жировой ткани наиболее информативны в отношении диагностики рецидивов или остаточных явлений поражений костного мозга
о Т1-ВИ без КУ и с КУ и подавлением сигнала жира увеличивают чувствительность в отношении диагностики очаговых поражений
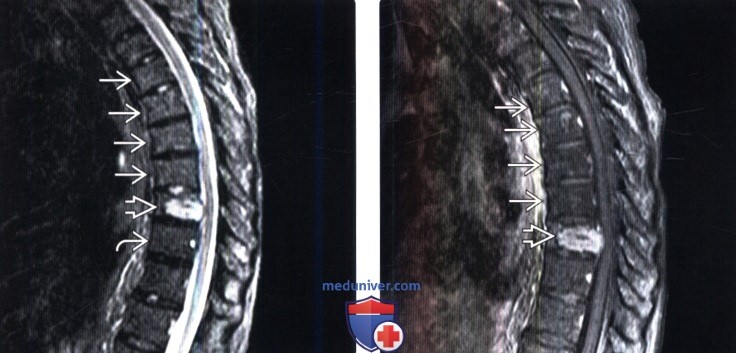
(Слева) Сагиттальный срез, Т1-ВИ шейно-грудного отдела позвоночника: признаки однородного усиления сигнала костного мозга грудных позвонков с достаточно хорошо выраженной переходной зоной этих изменений на уровне Т1-Т2, т. е. на уровне верхней границы области облучения.
(Справа) Сагиттальное Т1-ВИ с признаками гомогенной постлучевой жировой перестройки костного мозга грудных позвонков и четкими границами этих изменений, соответствующими границам области облучения.
в) Дифференциальная диагностика постлучевых изменений костного мозга:
1. Нормальный жировой костный мозг:
• Изменения коррелируют с возрастом пациента
• Преимущественная интенсивность сигнала соответствует жировой ткани, нередка некоторая неоднородность сигнала
• Отсутствие четких границ с неизмененным костным мозгом
• ± компрессионные переломы
• Отсутствие патологических изменений захвата изотопов при сцинтиграфии и ПЭТ
2. Гемангиома позвонка:
• Четко ограниченное округлое образование
• Типична гиперинтенсивность в Т1 и Т2, связанная с наличием жировой стромы
• Яркое контрастное усиление
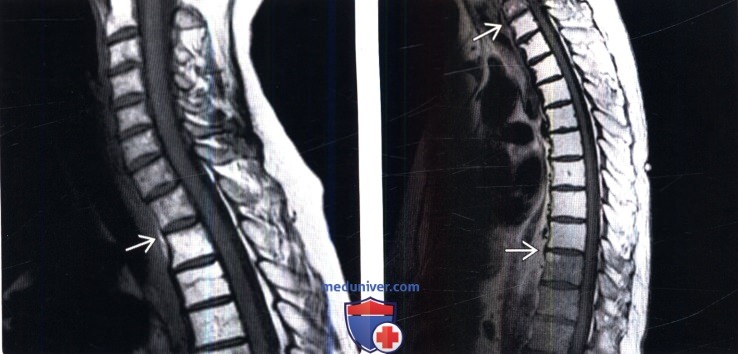
(Слева) На сагиттальном Т1-ВИ определяются признаки жировой перестройки костного мозга нижней половины тела Т5 и целиком тел и задних элементов Т6-Т8 позвонков. Обратите внимание на T9 позвонок, костный мозг которого практически полностью инфильтрирован опухолью.
(Справа) Сагиттальный срез, Т2-ВИ: признаки жировой перестройки костного мозга нижней половины тела Т5 и целиком тел и задних элементов Т6-Т8 позвонков. Костный мозг T9 позвонка инфильтрирован метастазом опухоли.
г) Патология:
1. Общие характеристики:
• Этиология:
о Лучевое повреждение гемопоэтических элементов костного мозга (отличающихся высокой радиочувствительностью)
о Сопутствующее снижение костной массы
о Изменения МР-сигнала костного мозга зависят от дозы облучения, ее фракционирования и времени, прошедшего с момента окончания терапии:
— Признаки жировой перестройки костного мозга появляются через две недели после облучения:
Через два месяца после облучения жировая перестройка наблюдается более, чем у 90% пациентов
— При дозе облучения 1,25 Гр ИС костного мозга не меняется
— При дозе в 50 Гр признаки жировой перестройки сохраняются и через девять лет после облучения:
Полное и необратимое исчезновение гемопоэтических элементов
— При дозах 20-30 Гр через 10 лет восстанавливается картина нормального костного мозга:
Частичное восстановление наступает в период от 2 до 9 лет
о Реконверсия жирового костного мозга в красный у детей наступает через 11-30 месяцев после облучения
• Генетика:
о Генетическая предрасположенность отсутствует
• Сочетанные изменения:
о Остеопения
о Остеопоротические компрессионные переломы
о Остеонекроз:
— Четкая граница между нормальным костным мозгом и зоной инфаркта
— МРТ:
Гиперинтенсивность в STIR и FS Т2
Гипоинтенсивность в Т1
± внутрипозвонковое жидкостное скопление
± КУ после внутривенного введения гадолиния
— Рентгенография, КТ:
± линейное скопление газа в теле позвонка, склероз
— Костная сцинтиграфия:
Отсутствие захвата изотопа, за исключением случаев развития коллапса тела позвонка
Бывает сложно отличить от рецидива метастатического поражения
о Для дифференциальной диагностики показана биопсия
о Рецидив или продолженный рост опухоли:
— Множественные дискретные очаги
— Парадуральный или паравертебральный мягкотканный компонент
— Патологические переломы
— Гипоинтенсивная в Т1 зона, окруженная жировым костным мозгом
— Гиперинтенсивность в STIR или FS Т2
— Очаговые образования после курса лечения могут не накапливать контраст
о Постлучевой миелит:
— Диффузная гиперинтенсивность Т2-сигнала спинного мозга в пределах области облучения
— Умеренная гипоинтенсивность в Т1
— Утолщение спинного мозга ± неправильной формы очаги контрастного усиления (некроз)
2. Микроскопия:
• Исследование на крысах, подвергшихся однократному облучению в дозе 20 Гр
• Снижение числа клеточных элементов и повреждение синусоидных сосудов:
о Сочетанные отек и кровоизлияния
• Восполнение клеточного состава костного мозга:
о Одновременное увеличение и жирового компонента
• Уменьшение клеточности костного мозга и уменьшение числа синусоидов:
о Фиброз с последующим увеличением жирового компонента
• Постепенная регенерация гемопоэтических элементов и синусоидов

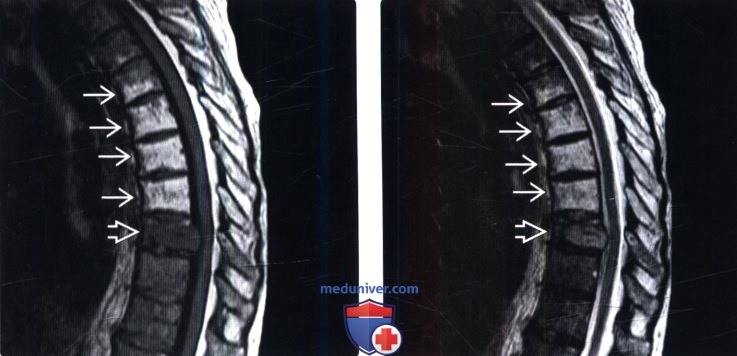
(Слева) На сагиттальном STIR МР-И у этого же пациента видно, что нормальный костный мозг и измененный в результате облучения костный мозг характеризуются практически одинаковой низкой интенсивностью сигнала, тогда как очаг метастатического поражения характеризуется высокой интенсивностью сигнала.
(Справа) На следующем сагиттальном FS T1-ВИ с КУ отмечается подавление сигнала и отсутствие контрастного усиления подвергшегося облучению и последующей жировой перестройке костного мозга нижней половины тела Т5 и тел и задних элементов Т6-Т8 позвонков. Тело T9 позвонка практически полностью замещено накапливающим контраст метастазом опухоли.
д) Клинические особенности:
1. Клиническая картина постлучевых изменений костного мозга:
• Наиболее распространенные симптомы/признаки:
о Обычно бессимптомное течение
• Другие симптомы/признаки:
о Боль (перелом)
о Миелопатия или радикулопатия вследствие компрессионного перелома или инфильтрации опухолью
• Особенности клинической картины:
о Развитие или прогрессирование болевого синдрома и неврологического дефицита обычно связано с постлучевым некрозом, переломами позвонков или рецидивом/прогрессирова-нием опухоли
2. Демография:
• Возраст:
о Дети и взрослые
• Пол:
о М = Ж
• Этническая предрасположенность:
о Отсутствует
• Эпидемиология:
о Ожидаемая находка у всех пациентов, подвергшихся лучевой терапии
3. Течение заболевания и прогноз:
• Восстановление картины нормального костного мозга при длительных сроках наблюдения за пациентами: > 10 лет
• Зависят в первую очередь от характера первичного заболевания, по поводу которого проводилась лучевая терапия
4. Лечение постлучевых изменений костного мозга:
• Ожидаемая находка после проведенной лучевой терапии, при отсутствии осложнений лечения не требует:
о Симптоматическая терапия при компрессионных переломах
о Хирургическое лечение при сдавлении спинного мозга или нестабильности позвоночника
е) Диагностическая памятка:
1. Следует учесть:
• Методом выбора при исследовании костного мозга является МРТ: Т2-ВИ FS или STIR и Т1 FS с КУ
2. Советы по интерпретации изображений:
• Гомогенная жировая перестройка костного мозга, четко отграниченная от неизмененного костного мозга, является характерным диагностическим признаком постлучевых изменений костного мозга
ж) Список использованной литературы:
1. Carmona R et al: Fat composition changes in bone marrow during chemotherapy and radiation therapy. Int J Radiat Oncol Biol Phys. 90(1):1 55-63, 2014
2. Bolan PJ et al: Water-fat MRI for assessing changes in bone marrow composition due to radiation and chemotherapy in gynecologic cancer patients. J Magn Reson Imaging. 38(6): 1578-84, 2013
3. Hwang S et al: Magnetic resonance imaging of bone marrow in oncology. Part 2. Skeletal Radiol. 36(11):1017-27, 2007
4. Tall MA et al: MR imaging of the spinal bone marrow. Magn Reson Imaging Clin N Am. 15(2): 1 75-98, vi, 2007
5. Foster К et al: MRI of the marrow in the paediatric skeleton. Clin Radiol. 59(8):651-73, 2004
6. Shih WJ et al: Tc-99m depreotide SPECT demonstrates photon-deficiency in the thoracic vertebrae after adjunct radiation therapy of lung cancer: correlation with MRI and bone scintigraphy. Ann Nucl Med. 17(3):245-8, 2003
7. Otake S et al: Radiation-induced changes in MR signal intensity and contrast enhancement of lumbosacral vertebrae: do changes occur only inside the radiation therapy field? Radiology. 222(1): 179-83, 2002
8. Onu M et al: Early MR changes in vertebral bone marrow for patients following radiotherapy. Eur Radiol. 11 (8): 1463-9, 2001
— Также рекомендуем «МРТ при передней поясничной радикулопатии»
Редактор: Искандер Милевски. Дата публикации: 20.9.2019
Источник
